题目内容
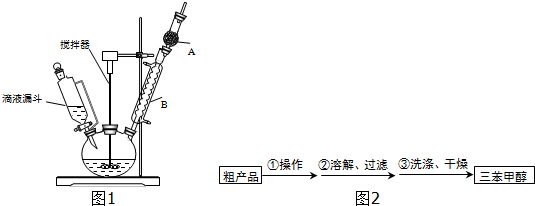
19.某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性.
(1)写出甲装置中电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)为完成上述实验,正确的连接顺序为A连E;B连C(填写导管口字母).
(3)对硬质玻璃管里的氧化铜粉末加热前,需要进行的操作为先通一段时间的氢气,检验氢气的纯度.
(4)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是淀粉碘化钾溶液,对应的现象为无色溶液变为蓝色.乙装置烧杯中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量.
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量.
①请你分析并回答:甲方案所测结果更准确.你认为不合理的方案的不足之处是因为空气中的CO2和H2O通过D口进入U型管,造成实验误差较大.
②若按合理方案测定的数据计算,Cu的相对原子质量为$\frac{16(c-a)}{b-c}$.
分析 (1)电解氯化钠溶液生成氢氧化钠、氢气以及氯气,根据离子方程式的书写方法来回答;
(2)在电解池的阴极上产生的是氢气,阳极上产生的是氯气,据实验目的来连接装置;
(3)电解饱和食盐水产生的氢气中含有水蒸气,会影响铜的相对原子质量的测定,需进行干燥,检验纯度;
(4)检验氯气的氧化性可以利用还原性的物质发生反应,且有明显的现象,可以把氯气通入淀粉碘化钾溶液发生氧化还原反应,生成碘单质遇淀粉变蓝;氯气需要用氢氧化钠溶液吸收;
(5)①乙方案中,装置中U型管也可能吸收空气中的CO2和水,影响测定结果;
②设出铜的原子量,利用关系式CuO~Cu及甲方案中的数据进行计算Cu的相对原子质量.
解答 解:(1)电解饱和食盐水生成氢氧化钠、氯气、氢气,反应离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)A是阴极,阴极上产生的是氢气,B是阳极,阳极上产生的是氯气,要用氢气来还还原氧化铜,所以A连接E,干燥氢气后用氢气来还原氧化铜,所以B连接C,
故答案为:E;C;
(3)加热氧化铜之前要检验纯度,否则加热易引起爆炸,可以先通一段时间的氢气,检验氢气的纯度,待纯净后,再对硬质玻璃管里的氧化铜粉末加热.
故答案为:先通一段时间的氢气,检验氢气的纯度;
(4)检验氯气的氧化性可以利用还原性的物质发生反应,且有明显的现象,可以把氯气通入淀粉碘化钾溶液发生氧化还原反应,生成碘单质遇淀粉变蓝;多余的氯气是污染性气体需要用氢氧化钠溶液进行吸收处理,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:淀粉KI溶液;无色溶液变为蓝色;Cl2+2OH-=Cl-+ClO-+H2O;
(5)①在乙方案中,应用装置中U型管也可能吸收空气中的CO2和水,会导致测定Cu的相对原子质量有误差,所以乙方案不合理,甲合理,
故答案为:甲;因为空气中的CO2和H2O通过D口进入U型管,造成实验误差较大;
②根据甲方案,设金属铜的原子量为M,则
CuO~Cu
M+16 M
b-a c-a
则:$\frac{M+16}{b-a}=\frac{M}{c-a}$,
解得:$\frac{16(c-a)}{b-c}$,
故答案为:$\frac{16(c-a)}{b-c}$.
点评 本题考查了难溶物溶度积的计算、化学实验基本操作方法及其应用,题目难度中等,明确实验目的本为解答关键,试题知识点较多,充分考查了学生的分析、计算能力及化学实验能力.

已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
请回答下列问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如图2提纯方案:其中,操作①的名称是蒸馏或分馏;洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已经洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
| A. | 水电离出的C(H+)=10-13mol/L的溶液中K+、NO3-、Br-、Cl- | |
| B. | 含有大量NO3-的水溶液:I-、Fe3+、H+、Na+ | |
| C. | 弱碱性溶液中HCO3-、NH4+、C2H5O-、MnO4- | |
| D. | 无色透明溶液中:Ba2+、S2-、Cu2+、AlO2- |
| A. | Y、Z元素最高价氧化物对应的水化物酸性较强的为H2ZO4 | |
| B. | 离子半径由大到小的顺序为:W>Z>Y | |
| C. | X、Z两种元素的气态氢化物中,X的气态氢化物较稳定,因为X的氢化物分子间有氢键 | |
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
| A. | 增大c(A)、c(B),K增大 | |
| B. | 降低温度,正反应速率增大 | |
| C. | 该反应的焓变为负值 | |
| D. | 该反应的化学方程式为2E(g)+F(g)?A(g)+2B(g) |
 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾.

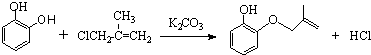 .
. 、
、 .
.