题目内容
3.A、B、C、D、E五种有机物,它们的分子分别由-CH3、-OH、-COOH、-CHO、-C6H5( 代表苯基)中的两种组成,这些化合物的性质如下所述:①A能够发生银镜反应,且相对分子质量为44;
②B溶液加入氯化铁溶液中,溶液显紫色;
③C和E在有浓硫酸存在并加热的条件下,能发生酯化反应,C和E的相对分子质量之比为8:15;
④B和E都能跟氢氧化钠溶液反应,而A、C、D则不能;
⑤D属于烃类,且D能使酸性高锰酸钾溶液褪色,还能发生硝化反应.
由此可知,A、B、C、D、E的结构简式是
ACH3CHO;B
 ;CCH3OH;D
;CCH3OH;D ;ECH3COOH.
;ECH3COOH.
分析 ①A能够发生银镜反应,说明含有醛基,且相对分子质量为44,为乙醛;
②B溶液加入氯化铁溶液中,溶液显紫色,说明含有酚羟基;
③C和E在有浓硫酸存在并加热的条件下,能发生酯化反应,则一种物质是醇、一种物质是羧酸,C和E的相对分子质量之比为8:15;
④B和E都能跟氢氧化钠溶液反应,而A、C、D则不能,C为酸、E为醇,C为CH3OH、E为CH3COOH,二者反应生成乙酸甲酯;
⑤D属于烃类,且D能使酸性高锰酸钾溶液褪色,还能发生硝化反应,说明D中含有苯环且苯环上含有甲基,则D为 ,以此解答该题.
,以此解答该题.
解答 解:A、B、C、D、E五种有机物,它们的分子分别由-CH3、-OH、-COOH、-CHO、-C6H5( 代表苯基)中的两种组成,
①A能够发生银镜反应,说明含有醛基,且相对分子质量为44,为乙醛,结构简式为CH3CHO;
②B溶液加入氯化铁溶液中,溶液显紫色,说明含有酚羟基,其结构简式为 ;
;
③C和E在有浓硫酸存在并加热的条件下,能发生酯化反应,则一种物质是醇、一种物质是羧酸,C和E的相对分子质量之比为8:15;
④B和E都能跟氢氧化钠溶液反应,而A、C、D则不能,C为酸、E为醇,C为CH3COOH、E为CH3OH,二者反应生成乙酸甲酯;
⑤D属于烃类,且D能使酸性高锰酸钾溶液褪色,还能发生硝化反应,说明D中含有苯环且苯环上含有甲基,则D为 ,
,
故答案为:CH3CHO; ;CH3OH;
;CH3OH; ;CH3COOH.
;CH3COOH.
点评 本题考查有机物推断,侧重考查学生分析判断能力,明确常见有机物官能团及其性质是解本题关键,知道常见有机反应现象,易错点是银镜反应方程式的书写,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
13.下列说法正确的是( )
| A. | 用丁达尔效应可区分胶体和溶液 | |
| B. | 煤可经分馏获得洁净的燃料 | |
| C. | 非金属材料中不可以含有金属元素 | |
| D. | 电解氯化镁饱和溶液,可制得金属镁 |
14.下列实验方法能达到相应实验目的是( )
| A. | 用BaCl2溶液鉴别Na2CO3和Na2SO4溶液 | |
| B. | 用淀粉溶液检验食盐中是否添加KIO3 | |
| C. | 用焰色反应并透过蓝色钴玻璃检验NaCl中是否混有KCl | |
| D. | 用溴水鉴别乙烯和二氧化硫两种气体 |
11.在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR,则 在此反应中,Y与R的化学式量之比为( )
| A. | 32:18 | B. | 16:11 | C. | 8:11 | D. | 16:9 |
18.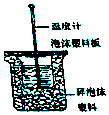 Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量不相等(填“相等”或“不相等”),但中和热应相等(填“相等”或“不相等”).
(4)记录的实验数据如表:
已知:Q=cm(t2-t1),反应后溶液的比热容C为4.18KJ•℃-1•Kg-1,各物质的密度均为1g•cm-3.根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ•mol-1
过氧化氢是重要的氧化剂,也可作还原剂,它的水溶液称为双氧水,常用于消毒、杀菌、漂白等.某化学研究性学习小组取一定量的市售过氧化氢溶液测定其中H2O2的含量,并探究它的有关性质.
Ⅱ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用酸式滴定管(填“酸式滴定管”或“碱式滴定管”);
(2)将上述溶液配制成250.00mL,配制过程需用到的玻璃仪器是烧杯、玻璃棒、250 mL容量瓶、胶头滴管(填名称);
(3)取25.00mL(2)中的溶液于锥形瓶中,用稀H2SO4酸化,并加适量蒸馏水稀释,用高锰酸钾标准液滴定.
①完成反应的离子方程式:
2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
②重复滴定三次,平均消耗C mol/L KMnO4标准液V mL,则原过氧化氢溶液中H2O2的质量分数为$\frac{17CV}{200ρ}$.
 Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量不相等(填“相等”或“不相等”),但中和热应相等(填“相等”或“不相等”).
(4)记录的实验数据如表:
| 实验用品 | 溶液温度 | |||
| t1 | t2 | |||
| ① | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.3℃ |
| ② | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.5℃ |
| 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 21.5℃ | |
过氧化氢是重要的氧化剂,也可作还原剂,它的水溶液称为双氧水,常用于消毒、杀菌、漂白等.某化学研究性学习小组取一定量的市售过氧化氢溶液测定其中H2O2的含量,并探究它的有关性质.
Ⅱ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用酸式滴定管(填“酸式滴定管”或“碱式滴定管”);
(2)将上述溶液配制成250.00mL,配制过程需用到的玻璃仪器是烧杯、玻璃棒、250 mL容量瓶、胶头滴管(填名称);
(3)取25.00mL(2)中的溶液于锥形瓶中,用稀H2SO4酸化,并加适量蒸馏水稀释,用高锰酸钾标准液滴定.
①完成反应的离子方程式:
2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
②重复滴定三次,平均消耗C mol/L KMnO4标准液V mL,则原过氧化氢溶液中H2O2的质量分数为$\frac{17CV}{200ρ}$.
15.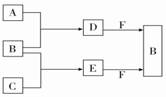 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )| A. | F中阴阳离子个数比为1:1 | |
| B. | 化合物F中既有离子键又有共价键 | |
| C. | 合成过程中的反应均是氧化还原反应 | |
| D. | 1mol F与E反应时转移的电子数为NA(NA为阿伏伽德罗常数的值) |
12.下列各组物质中,不是按 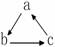 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | HNO2 | CH2=CH2 | NaOH | Fe |
| b | NO | CH3CH2Br | NaHCO3 | FeCl3 |
| c | NO2 | CH3CH2OH | Na2CO3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
13.下列说法中正确的是( )
| A. | 乙烯中 C=C 的键能是乙烷中 C-C 的键能的 2 倍 | |
| B. | 同一原子中,2p,3p,4p 能级的轨道数目依次增多 | |
| C. | C-O 键的极性比 N-O 键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |