题目内容
【题目】下表是元素周期表的一部分. 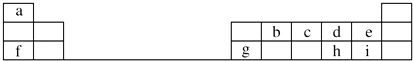
回答下列问题:
(1)元素b在元素周期表中的位置是 .
(2)元素a与c形成的4核10电子分子的化学式为 , 其水溶液呈性.
(3)元素e的负一价离子的结构示意图为 , 元素g的简单离子的结构示意图为 , 二者的离子半径大小顺序为 .
(4)元素i的气态氢化物比元素e的气态氢化物(填“稳定”或“不稳定”).
(5)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为 , 该化合物中所含的化学键类型为 .
(6)元素d与h形成的化合物的化学式为
【答案】
(1)第二周期ⅣA族
(2)NH3;碱
(3)![]() ;
; ;F﹣>Al3+
;F﹣>Al3+
(4)不稳定
(5)![]() ;离子键、共价键
;离子键、共价键
(6)SO2、SO3
【解析】解:由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为F、f为Na、g为Al、h为S、i为Cl.
(1.)由位置可知,b处于周期表中第二周期ⅣA族,所以答案是:第二周期ⅣA族;
(2.)元素a与c形成的4核10电子分子为NH3 , 氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致其水溶液呈碱性,所以答案是:NH3;碱性;
(3.)F﹣离子质子数为9,核外有2电子层,各层电子数为2、8,离子结构示意图为 ![]() ,Al3+离子质子数为13,核外有2电子层,各层电子数为2、8,离子结构示意图为
,Al3+离子质子数为13,核外有2电子层,各层电子数为2、8,离子结构示意图为  ,
,
F﹣、Al3+ , 离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:F﹣>Al3+ , 所以答案是: ![]() ;
;  ;F﹣>Al3+;
;F﹣>Al3+;
(4.)非金属性Cl<F,元素非金属性越强,其氢化物越稳定,故HCl不如HF稳定,所以答案是:不稳定;
(5.)氯气单质溶于NaOH中生成具有漂白作用的盐为NaClO,由钠离子与次氯酸根离子构成,次氯酸根离子中氧原子与氯原子之间形成1对共用电子对,电子式为 ![]() ,含有离子键、共价键,所以答案是:
,含有离子键、共价键,所以答案是: ![]() ;离子键、共价键;(6)元素d与h形成的化合物有二氧化硫、三氧化硫,相应的化学式为SO2、SO3 , 所以答案是:SO2、SO3 .
;离子键、共价键;(6)元素d与h形成的化合物有二氧化硫、三氧化硫,相应的化学式为SO2、SO3 , 所以答案是:SO2、SO3 .

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】下列有机化学反应方程式及反应类型均正确的是( )
选项 | 化学反应方程式 | 反应类型 |
A | CH3COOH+CH3CH2OH | 酯化反应 |
B | CH4+Cl2 | 置换反应 |
C | CH2=CH2+Br2→CH3CHBr2 | 加成反应 |
D |
| 取代反应 |
A.A
B.B
C.C
D.D