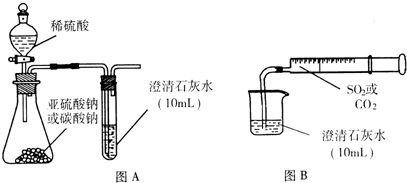
题目内容
将SO2,分别通入下列溶液中:①石蕊试液 ②溴水 ③氢硫酸 ④品红溶液。在下表中填写分别观察到什么现象,表现了SO2的哪些性质,并写出有关反应的化学方程式。|
溶液 |
实验现象 |
SO2的改制 |
化学方程式 |
|
(1)石蕊试液 |
|
|
|
|
(2)溴水 |
|
|
|
|
(3)氢硫酸 |
|
|
|
|
(4)品红溶液 |
|
|
|
答案:
解析:
解析:
现象 SO2的 性质 化学方程式 (1)石蕊试液 紫色变红色 SO2是亚硫酸 的酸酐 SO2+H2O==H2SO4 (2)溴水 橙色褪去 SO2的还原性 SO2=Br2+2H2O===H2SO4+2HBr 溶液 试验现象 SO2的性质 化学方程式 (3)氢硫酸 出现淡黄色混浊 SO2的氧化性 SO2+2H2S===3S+2H2O (4)品红溶液 红色褪去,但加热后红色再现 SO2的漂白性
|

练习册系列答案
相关题目