题目内容
工业上合成氨在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g) △H=-92.44
kJ/mol。其部分工艺流程如下图所示:
2NH3(g) △H=-92.44
kJ/mol。其部分工艺流程如下图所示:

(1)合成氨所需要的原料气中,氮气取自 ,氢气来源于 。
(2)对原料气进行净化处理的目的是 。
(3)设备A的名称是 ,设备B的名称是 。
(4)在20~50 Mpa时,工业合成氨选择在400—500℃的温度进行反应,
主要原因是 。
(5)据《科学》杂志报道,希腊化学家在常压下将氢气和用氢气稀释的氮气分别通人一个加热到570℃的电解池(如图)中,氢和氮在电极上合成了氨,且转化率达到了78%。则:阳极反应为 ,阴极反应为 。


【解析】略

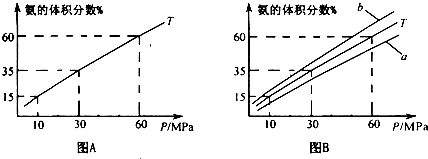
(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为TC时平衡混合物中氨气的体积分数与压强(P)的关系图.

①写出工业上合成氨的化学方程式 .
②图A中氨气的体积分数为15.00%时,H2的转化率= .
③图B中T=500°C,温度为450C对应的曲线是 (选填字母“a“或“b”),选择的理由是
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是 (写出一条即可).
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O
 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
| 时间/min | CH4(mol) | H20( mol) | CO (mol) | H2 (mol) |
| 0.40 | 1.00 | |||
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |
前5min平均反应速率v(CH4)= .
②反应在7~10min之间,CO的物质的量减少的原因可能是 (填字母).
a?减少CH4 b?降低温度c?增大压强d?充入H2
③若保持温度不变,向1L容器中起始充入0.15mol CH4.0.45mol H2O. mol CO、 mol H2,达到平衡时CH4的体积百分含量与第一次投料相同.
(15 分)
合成氨对化学工业和国防工业具有重要意义。
(1) 向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T0C时平衡混合物中氨气的体积分数与压强(P)的关系图。

①写出工业上合成氨的化学方程式_____________________。
②图A中氨气的体积分数为15.00%时,H2的转化率=_______ 。
③图B中T=5000C,温度为4500C对应的曲线是_______(选填字母“a"或“b ”),选择的理由是______________
④由图像知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是_______(写出一条即可)。
(2) 合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
![]()
(3) 一定温度下,在2 L容器中发生上述反应,各物质的物质的量变化如下表
| 时间/min | CH4(mol) | H20( mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |

 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)