题目内容
20.50mL 18.4mol/L浓硫酸与Cu反应后,将所得溶液稀释至500mL,所得溶液pH=0,计算稀释后溶液中硫酸铜的物质的量浓度.分析 发生反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,根据反应后溶液的pH可计算出剩余硫酸的浓度,然后根据n=cV计算出反应消耗硫酸的物质的量,再结合反应方程式计算出反应生成硫酸铜的物质的量,最后根据c=$\frac{n}{V}$计算出稀释后溶液中硫酸铜的物质的量浓度.
解答 解:反应后溶液的pH=0,则反应后溶液中氢离子浓度为1mol/L,说明反应后溶液中硫酸的浓度为:1mol/L×$\frac{1}{2}$=0.5mol/L,剩余硫酸的物质的量为:0.5mol/L×0.5L=0.25mol,
50mL 18.4mol/L浓硫酸中含有硫酸的物质的量为:18.4mol/L×0.05L=0.92mol,
则反应消耗硫酸的物质的量为:0.92mol-0.25mol=0.67mol,根据反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,反应生成硫酸铜的物质的量为:0.67mol×$\frac{1}{2}$=0.335mol,
稀释后溶液中硫酸铜的物质的量浓度为:$\frac{0.335mol}{0.5L}$=0.67mol/L,
答:稀释后溶液中硫酸铜的物质的量浓度为0.67mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确发生反应原理为解答关键,注意掌握物质的理念的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列判断反应自发性的描述正确的是( )
| A. | 焓减少的反应一定可以自发进行 | B. | 焓增加的反应可能自发进行 | ||
| C. | 熵增加的反应一定可以自发进行 | D. | 熵减少的反应一定不能自发进行 |
11.在一定温度下的恒容密闭容器中,发生可逆反应 2A(g)+B(g)?2C(g),下列叙述不能作为达到平衡的标志的是( )
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内2a mol A生成,同时生成a mol B | |
| C. | A、B、C的浓度不再变化 | |
| D. | 混合气体的总压强不再变化 |
8.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 氨气的摩尔质量是17g | |
| B. | NA个氢分子和NA个氧分子的质量比为1:16 | |
| C. | 标准状况下,22.4 L水中含有的分子数目为NA | |
| D. | 100 mL1mol/L MgCl2溶液中含有 0.1 mol Cl- |
15.在密闭容中发生下列反应aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.9倍,下列叙述正确的是( )
| A. | a>c+d | B. | 平衡向正反应方向移动 | ||
| C. | D的体积分数变大 | D. | A的转化率变小 |
5.分子式为C2H6O的可能是甲醚或乙醇,可采用化学方法及物理方法加以鉴别,下列鉴别方法中不能对二者进行鉴别的是( )
| A. | 利用金属钠或者金属钾 | B. | 利用质谱 | ||
| C. | 利用红外光谱法 | D. | 利用核磁共振氢谱 |
12.人类社会的发展离不开科学家的贡献,下列说法中正确的是( )
| A. | 汤姆生--提出带核的原子结构模型 | |
| B. | 维勒--合成尿素实现了无机物向有机物的转化 | |
| C. | 玻尔--根据ɑ粒子散射现象提出原子结构的量子力学模型 | |
| D. | 侯德榜--侯氏制碱法的原理是将氨气通入二氧化碳的氯化钠饱和溶液中 |
9.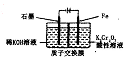 电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
 电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )| A. | 阳极反应为Fe-2e-=Fe2+ | |
| B. | 在阴极室,发生的电极反应为:Cr2O72-+6e-+7H2O=Cr(OH)3+8OH- | |
| C. | 在阳极室,pH增大会有Fe(OH)3沉淀生成 | |
| D. | 电路中每转移12 mol电子,最多有1 mol Cr2O72- 被还原 |
3.四种短周期元素X、Y、Z、W,已知X、Y的阳离子a Xn+、b Y(n+1)+电子层结构与Z、W的阴离子c Zm-、d W(m+1)-电子层结构相同.下列叙述正确的是( )
| A. | 最高价氧化物对应水化物的碱性大小顺序一定是:X>Y | |
| B. | 离子半径和原子半径由大到小的顺序均为X>Y>Z>W | |
| C. | 氢化物的稳定性是Z<W | |
| D. | 还原性Z m->W(m+1)-,氧化性Xn+>Y(n+1)+ |