题目内容
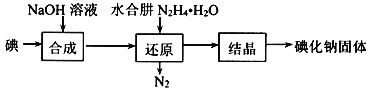
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体(ZnCl2·xH2O)的工艺流程如图:
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22-。
(1)碱溶时加入过量NaOH溶液的目的是___,发生反应的化学方程式是___。
(2)沉淀A的主要成分的化学式是___。
(3) “调pH”步骤中通入过量CO2,化学反应方程式___。
(4)酸溶时发生反应的离子方程式是___。
(5)一系列操作过程中的一系列操作是:___、___、过滤、洗涤、干燥。
【答案】溶解氧化锌,将其与氧化亚铁和氧化铜分离 ZnO+2NaOH=Na2ZnO2+H2O CuO、FeO Na2ZnO2+2CO2+2H2O=Zn(OH)2↓+2NaHCO3 Zn(OH)2+2H+=Zn2++2H2O 蒸发浓缩 冷却结晶
【解析】
炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)中加入NaOH,由于ZnO具有两性,能与NaOH反应生成Na2ZnO2和H2O,而CuO和FeO不溶,于是成为沉淀A的主要成分;滤液中通入过量CO2调节pH,Na2ZnO2生成Zn(OH)2沉淀,CO2转化为NaHCO3;加入盐酸酸溶,Zn(OH)2转化为ZnCl2;蒸发浓缩、冷却结晶,过滤、洗涤、干燥,便可获得氯化锌晶体。
(1)从以上分析可知,碱溶时加入过量NaOH溶液,ZnO与NaOH反应生成Na2ZnO2和H2O,而CuO和FeO不溶,从而得出其目的是溶解氧化锌,将其与氧化亚铁和氧化铜分离;发生反应的化学方程式是ZnO+2NaOH=Na2ZnO2+H2O。答案为:溶解氧化锌,将其与氧化亚铁和氧化铜分离;ZnO+2NaOH=Na2ZnO2+H2O;
(2)因为加入NaOH后,CuO和FeO不溶,所以沉淀A的主要成分的化学式是CuO、FeO。答案为:CuO、FeO;
(3) “调pH”步骤中通入过量CO2,Na2ZnO2生成Zn(OH)2沉淀,CO2转化为NaHCO3,化学反应方程式Na2ZnO2+2CO2+2H2O=Zn(OH)2↓+2NaHCO3。答案为:Na2ZnO2+2CO2+2H2O=Zn(OH)2↓+2NaHCO3;
(4)酸溶时,Zn(OH)2与盐酸反应,转化为ZnCl2和水,发生反应的离子方程式是Zn(OH)2+2H+=Zn2++2H2O。答案为:Zn(OH)2+2H+=Zn2++2H2O;
(5)从溶液中提取溶质,需要蒸发结晶,所以一系列操作过程中的一系列操作是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。答案为:蒸发浓缩;冷却结晶。

 阅读快车系列答案
阅读快车系列答案