题目内容
1.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.根据下表中短周期元素的原子半径和主要化合价,回答表后的问题.| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 0.89 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(2)①④⑦三种元素的氢化物的稳定性由强到弱的顺序为H2O>NH3>PH3(填化学式)
(3)元素④构成的两种单质互称为同素异形体(填“同位素”、“同素异形体”或“同分异构体”)
(4)请写出下列元素形成的常见化合物的电子式:
③⑤
 、②⑤
、②⑤ 、③⑦
、③⑦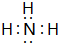
(5)工业制备⑧的过程中,被电解的物质是Al2O3(填化学式),属于离子(填“离子”或“共价”)化合物
(6)请写出⑤⑧两种元素的最高价氧化物对应水化物间反应的离子方程式:3H++Al(OH)3═Al3++3H2O.
分析 短周期元素中,元素②⑥均有最高价+2,处于ⅡA,原子半径②>⑥,则②为Mg、⑥为Be;元素①只有最低价-2,没有最高价,故①为O元素;元素④⑦均有最高价+5、最低价-3,处于ⅤA族,原子半径④>⑦,则④为P元素、⑦为N元素;⑧有最高价+3,处于ⅢA族,原子半径大于P原子,故⑧为Al;元素⑤有最高价+7、最低价-1,故⑤为Cl;元素③有最高价+1,处于IA族,原子半径小于O,故③为H元素,据此解答.
解答 解:短周期元素中,元素②⑥均有最高价+2,处于ⅡA,原子半径②>⑥,则②为Mg、⑥为Be;元素①只有最低价-2,没有最高价,故①为O元素;元素④⑦均有最高价+5、最低价-3,处于ⅤA族,原子半径④>⑦,则④为P元素、⑦为N元素;⑧有最高价+3,处于ⅢA族,原子半径大于P原子,故⑧为Al;元素⑤有最高价+7、最低价-1,故⑤为Cl;元素③有最高价+1,处于IA族,原子半径小于O,故③为H元素.
(1)元素⑧为Al,处于第三周期,上述元素中与元素⑧处于同一周期的有:Mg、P、Cl,故答案为:Mg、P、Cl;
(2)非金属性O>N>P,故氢化物稳定性:H2O>NH3>PH3,故答案为:H2O>NH3>PH3;
(3)元素④构成的两种单质互称为:同素异形体,故答案为:同素异形体;
(4)③⑤形成化合物为HCl,电子式为 ,②⑤形成化合物为MgCl2,电子式为
,②⑤形成化合物为MgCl2,电子式为 ,③⑦形成化合物为NH3,电子式为
,③⑦形成化合物为NH3,电子式为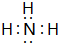 ,
,
故答案为: ;
; ;
;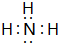 ;
;
(5)工业电解熔融Al2O3制备Al,氧化铝属于离子化合物,故答案为:Al2O3;离子;
(6)⑤⑧两种元素的最高价氧化物对应水化物分别为HClO4、Al(OH)3,二者反应的离子方程式:3H++Al(OH)3═Al3++3H2O,
故答案为:3H++Al(OH)3═Al3++3H2O.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握.

| A. | 摩尔质量:g | B. | 密度:g•mL-1 | ||
| C. | 气体摩尔体积:L•mol-1 | D. | 阿伏加德罗常数:mol-1 |
| A. | 原子核外的各个电子层最多能容纳的电子数是2n2个 | |
| B. | 原子核外的每个电子层所容纳的电子数都是2n2个 | |
| C. | 原子的最外层由1~2个电子的元素都是活泼的金属元素 | |
| D. | 非金属元素原子最外层数目都大于4 |
| A. | 使用滴定管时,滴定管必须用待装液润洗2~3次 | |
| B. | 酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液或强氧化性溶液 | |
| C. | 盛装准确量取的待测液的锥形瓶应预先用待测液润洗 | |
| D. | 滴定终点时,若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进行调整 |
| A. | N2的结构式 N≡N | B. | 氯化铵的电子式 | C. | S2-的结构示意图 | D. | 甲烷的比例模型  |
| A. | 石油的催化裂化 | B. | 煤的气化 | ||
| C. | 煤的高温干馏 | D. | 石油分馏得到汽油,柴油等 |




 ;吸收装置中的温度不能过高,其原因是:防止H2O2的分解.
;吸收装置中的温度不能过高,其原因是:防止H2O2的分解. 某课外兴趣小组进行了中和热测定实验,据此回答下列问题:用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.
某课外兴趣小组进行了中和热测定实验,据此回答下列问题:用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.