题目内容
工业制氢气的一个重要反应是:
已知在25℃时:

则2 5℃时1 mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为:


已知在25℃时:

则2 5℃时1 mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为:

B
试题分析:根据题给反应:①C(石墨)+
 O2(g)═CO(g)△H=-111kJ/mol;
O2(g)═CO(g)△H=-111kJ/mol;②H2(g)+
 O2(g)=H2O(g)△H=-242kJ/mol;③C(石墨)+O2(g)═CO2(g)△H=-394kJ/mol;依据盖斯定律③-①-②得到:CO(g)+H2O(g)=CO2(g)+H2(g),△H=-41KJ/mol;选B。
O2(g)=H2O(g)△H=-242kJ/mol;③C(石墨)+O2(g)═CO2(g)△H=-394kJ/mol;依据盖斯定律③-①-②得到:CO(g)+H2O(g)=CO2(g)+H2(g),△H=-41KJ/mol;选B。
练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
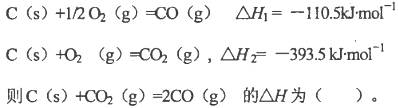

 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。



 ,△H=__________kJ
,△H=__________kJ (用含a、b、c、d的式子表示)。
(用含a、b、c、d的式子表示)。
 (CO)___________B点的逆反应速率
(CO)___________B点的逆反应速率

 H2(g)+
H2(g)+ kJ·mol-1
kJ·mol-1
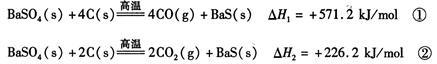
 2CO(g)的△H = kJ/mol
2CO(g)的△H = kJ/mol = 。[已知:
= 。[已知: