题目内容
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种元素为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是________.
(2)ZW2的电子式是________.
(3)工业生产单质Y的原理是________(用化学方程式表示).
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是:________.
(5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是:________.
答案:
解析:
解析:
答案: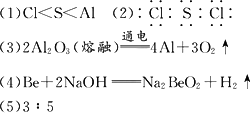
解析:因X原子的最外层电子数与次外层电子数相等,在短周期中只有Be符合条件;又X与W、Y与Z这两对原子的最外层电子数之和均为9,则W原子的最外层电子数必为7,可能为F或Cl;由单质Y和W都可与浓的NaOH溶液反应,且X、Y、Z、W是原子序数依次增大且互不同族,则Y是Al,Z为S,W为Cl.0.1 mol的Cl2与0.075 mol的FeBr2溶液反应,由于Fe2+的还原性比Br-强,Cl2先氧化0.075 mol Fe2+需0.0375 mol,故被氧化的Fe2+和Br-的物质的量之比是0.075∶(0.1-0.0375)×2=0.075∶0.125=3∶5.

练习册系列答案
相关题目

