题目内容
某一条件下NH4NO3受热分解的方程式为NH4NO3→N2+HNO3+H2O(未配平),则该反应中氧化产物和还原产物之比为
- A.1:1
- B.5:3
- C.4:9
- D.3:5
B
分析:先根据氧化还原反应中得失电子相等配平方程式,还原剂对应的产物是氧化产物,氧化剂对应的产物是还原产物,从而确定氧化产物和还原产物之比.
解答:该分子中铵根离子中的氮原子失电子,一个铵根离子失去3个电子生成氮原子,硝酸根离子中的氮原子得电子,一个硝酸根离子得到5个电子生成氮原子,其最小公倍数是15,所以其反应方程式为5NH4NO3=4N2+2HNO3+9H2O.所以氧化剂和还原剂都是硝酸铵,氧化产物和还原产物都是氮气,氧化产物和还原产物之比=铵根离子和参加氧化还原反应的硝酸根离子之比=5:3。
故选B.
点评:本题考查了氧化还原反应中的有关计算,难度不大,能根据得失电子守恒配平该反应方程式是解本题的关键.

练习册系列答案
相关题目


 某环保部门调查指出:大气中的酸性气体有相当一部分来自全国数以万计的高校、中学的化学实验室.为此某校化学研究小组的同学拟从下面提供的实验用品中选取合适的装置和药品,组装成一套实验装置,用来粗略测定实验室里空气中全部酸性气体的体积分数.
某环保部门调查指出:大气中的酸性气体有相当一部分来自全国数以万计的高校、中学的化学实验室.为此某校化学研究小组的同学拟从下面提供的实验用品中选取合适的装置和药品,组装成一套实验装置,用来粗略测定实验室里空气中全部酸性气体的体积分数.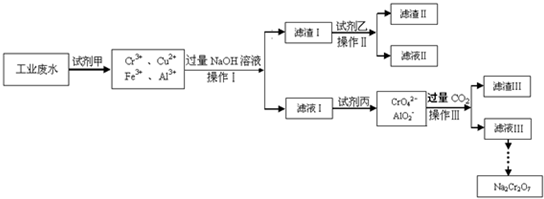
 NaCrO2
NaCrO2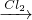 Na2CrO4
Na2CrO4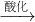 Na2Cr2O7
Na2Cr2O7