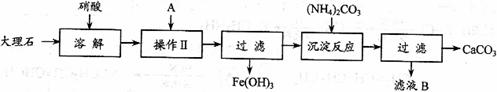
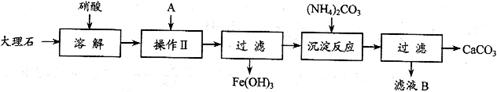
题目内容
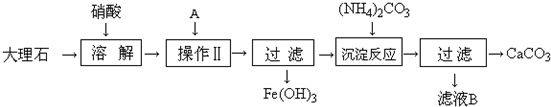
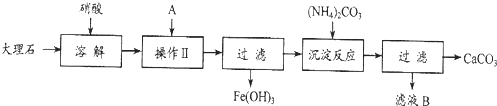
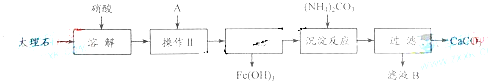
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙.大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
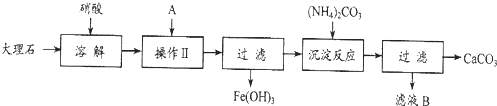
(1)溶解大理石时,用硝酸而不同硫酸的原因是______.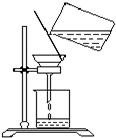
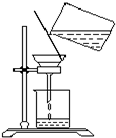
(2)过滤时,某学生的操作如图所示,请指出图中的错误是.______.
(3)检验滤液中是否含铁,选用的试剂是______,现象______,反应的离子方程式:______.
(4)写出加入碳酸铵所发生反应的离子方程式:______.
解:(1)H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生,溶解大理石时,用硝酸是因为大理石溶于硝酸后生成Ca(NO3)2,Ca(NO3)2易溶于水,
故答案为:硫酸钙微溶于水;
(2)过滤实验中:滤纸紧贴漏斗内壁;滤纸边缘低于漏斗边缘,液面低于滤纸边缘;倾倒液体的烧杯口要紧靠玻璃棒,玻璃棒下端要紧靠三层滤纸处,漏斗下端管口的尖嘴要紧靠承接滤液的烧杯内壁,图中的错误是玻璃棒下端没有(或应该)靠在(三层)滤纸上、漏斗颈没有(或应该)靠在烧杯内壁,
故答案为:玻璃棒下端没有(或应该)靠在(三层)滤纸上、漏斗颈没有(或应该)靠在烧杯内壁;
(3)过滤后的溶液中是否含铁,如含有,铁应以Fe3+形式存在,Fe3+遇KSCN溶液变为血红色,硫氰化钾溶液作为检验Fe3+的特征试剂,反应的离子方程式Fe3++3SCN-=Fe(SCN)3,
故答案为:硫氰化钾溶液;溶液呈血红色;Fe3++3SCN-=Fe(SCN)3;
(4)过滤后的溶液中含有大量的Ca2+,加入碳酸铵发生复分解反应生成碳酸钙沉淀,反应后的离子方程式为Ca2++CO32-=CaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;
分析:(1)CaSO4微溶于水,Ca(NO3)2易溶于水;
(2)根据过滤实验中的“一贴二低三靠”进行解答;
(3)大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加CaCO3或氨水的方法调节pH,使Fe3+以Fe(OH)3的形式除去,检验滤液中是否含铁,如含有,铁应以Fe3+形式存在,硫氰化钾溶液和铁离子反应生成血红色物质;
(4)碳酸根离子和钙离子反应生成碳酸钙沉淀;
点评:本题考查物质的分离、提纯和除杂等实验问题,注意实验基本操作方法,把握实验原理是解题的关键,题目难度中等.
故答案为:硫酸钙微溶于水;
(2)过滤实验中:滤纸紧贴漏斗内壁;滤纸边缘低于漏斗边缘,液面低于滤纸边缘;倾倒液体的烧杯口要紧靠玻璃棒,玻璃棒下端要紧靠三层滤纸处,漏斗下端管口的尖嘴要紧靠承接滤液的烧杯内壁,图中的错误是玻璃棒下端没有(或应该)靠在(三层)滤纸上、漏斗颈没有(或应该)靠在烧杯内壁,
故答案为:玻璃棒下端没有(或应该)靠在(三层)滤纸上、漏斗颈没有(或应该)靠在烧杯内壁;
(3)过滤后的溶液中是否含铁,如含有,铁应以Fe3+形式存在,Fe3+遇KSCN溶液变为血红色,硫氰化钾溶液作为检验Fe3+的特征试剂,反应的离子方程式Fe3++3SCN-=Fe(SCN)3,
故答案为:硫氰化钾溶液;溶液呈血红色;Fe3++3SCN-=Fe(SCN)3;
(4)过滤后的溶液中含有大量的Ca2+,加入碳酸铵发生复分解反应生成碳酸钙沉淀,反应后的离子方程式为Ca2++CO32-=CaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;
分析:(1)CaSO4微溶于水,Ca(NO3)2易溶于水;
(2)根据过滤实验中的“一贴二低三靠”进行解答;
(3)大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加CaCO3或氨水的方法调节pH,使Fe3+以Fe(OH)3的形式除去,检验滤液中是否含铁,如含有,铁应以Fe3+形式存在,硫氰化钾溶液和铁离子反应生成血红色物质;
(4)碳酸根离子和钙离子反应生成碳酸钙沉淀;
点评:本题考查物质的分离、提纯和除杂等实验问题,注意实验基本操作方法,把握实验原理是解题的关键,题目难度中等.

练习册系列答案
相关题目