题目内容
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.拆开物质中的化学键一定需要吸收能量 |
| C.应用盖斯定律,无法计算某些难以直接测量的反应焓变 |
| D.化学反应都伴随着能量变化和其他各种现象的出现 |
B
解析试题分析:A、生成物的总能量不一定低于反应物质的总能量,错误;B、正确;C、应用盖斯定律,可以计算某些难以直接测量的反应焓变,错误;D、化学反应都伴随着能量变化,能量的变化可以会以一些现象表现出来,但不一定各种现象都有。错误。
考点:考查反应热的有关知识。

根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
(2)H2(g)+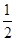 O2(g)=H2O(1) △H2=-285.8 kJ/mol
O2(g)=H2O(1) △H2=-285.8 kJ/mol
(3)CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(1)的△H为
| A.△H=+244.1kJ/mol | B.△H=-488.3 kJ/mol |
| C.△H=-996.6 kJ/mol | D.△H=+996.6 kJ/mol |
下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
| A.C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) |
| B.2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1(反应热) |
| C.C2H5OH+3O2=2CO2+3H2O ΔH=-1368.8 kJ·mol-1(反应热) |
| D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热) |
未来新能源的特点是资源丰富、对环境污染小,且可以再生。下列属于未来新能源的是
①天然气 ②煤 ③氢能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能
| A.①②③④ | B.③⑤⑥⑦ | C.④⑤⑥⑦ | D.①③⑤⑥ |
已知下列热化学方程式:
2Zn(s)+O2(g) = 2ZnO(s) ΔH=-702.2 kJ·mol-1
Hg(l)+1/2O2(g) = HgO(s) ΔH=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s) = ZnO(s)+Hg(l)的反应热ΔH为( )
| A.-260.4 kJ·mol-1 | B.+260.4 kJ·mol-1 |
| C.-611.5 kJ·mol-1 | D.+520.8 kJ·mol-1 |
生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如下图转化。下列说法不正确的是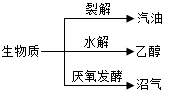
| A.汽油属于纯净物 |
| B.乙醇属于可再生能源 |
| C.沼气的主要成分是甲烷 |
| D.生物质能来源于太阳能 |
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂。
已知:H2(g)+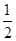 O2(g)=H2O(l)
O2(g)=H2O(l)
ΔH1=-285.8 kJ·mol-1①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1②
O2(g)=O2(l) ΔH3=-6.84 kJ·mol-1③
H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1④
下列说法正确的是( )
| A.上述四个反应都是吸热反应 |
| B.1 mol液态H2的能量大于1 mol气态H2的能量 |
| C.H2的燃烧热ΔH为-285.8 kJ·mol-1 |
D.火箭中液氢燃烧的热化学方程式为H2(l)+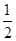 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 |
在一定条件下,充分燃烧一定量的丁烷,放出热量为
Q kJ(Q>0),经测定完全吸收生成的二氧化碳需要消耗5 mol·L-1的KOH溶液100 mL,恰好生成正盐,则此条件下反应C4H10(g)+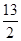 O2(g)=4CO2(g)+5H2O(g)的ΔH为( )
O2(g)=4CO2(g)+5H2O(g)的ΔH为( )
| A.+8Q kJ·mol-1 | B.-8Q kJ·mol-1 |
| C.+16Q kJ·mol-1 | D.-16Q kJ·mol-1 |
 2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea-Eb)kJ·mol-1。其归纳正确的是 ( )
2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea-Eb)kJ·mol-1。其归纳正确的是 ( )