题目内容
11.方程式(1)氯化铁溶液中滴入几滴KSCN溶液的离子方程式Fe3++3SCN-=Fe(SCN)3
(2)少量Ba(OH)2溶液滴入NaHCO3溶液的离子方程式Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32-
(3)MnO2与浓盐酸共热生成黄绿色气体的化学方程式MnO2+4HCl(浓)=$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(4)250℃,硝酸铵分解得到与CO2互为等电子体的含氮氧化物和水的化学方程式NH4NO3$\frac{\underline{\;250℃\;}}{\;}$N2O↑+2H2O↑.
分析 (1)氯化铁溶液中滴入几滴KSCN溶液,Fe3+和SCN-发生络合反应生成Fe(SCN)3而显红色;
(2)设量少的Ba(OH)2的物质的量为1mol,根据1molBa(OH)2含1molBa2+和2molOH-来分析所需的HCO3-物质的量;
(3)MnO2与浓盐酸共热除了生成黄绿色气体即氯气外,还生成氯化锰和水;
(4)与CO2互为等电子体的含氮氧化物为N2O.
解答 解:(1)氯化铁溶液中滴入几滴KSCN溶液,Fe3+和SCN-发生络合反应生成Fe(SCN)3而显红色,离子方程式为:Fe3++3SCN-=Fe(SCN)3,故答案为:Fe3++3SCN-=Fe(SCN)3;
(2)设量少的Ba(OH)2的物质的量为1mol,由于1molBa(OH)2含2molOH-,故能消耗2molHCO3-,则离子方程式为:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32-,故答案为:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32-;
(3)MnO2与浓盐酸共热除了生成黄绿色气体即氯气外,还生成氯化锰和水,故化学方程式为MnO2+4HCl(浓)=$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)=$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)250℃,硝酸铵分解得到与CO2互为等电子体的含氮氧化物和水,而与CO2互为等电子体的含氮氧化物为N2O,故化学方程式为:NH4NO3$\frac{\underline{\;250℃\;}}{\;}$N2O↑+2H2O↑,故答案为:NH4NO3$\frac{\underline{\;250℃\;}}{\;}$N2O↑+2H2O↑.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

 阅读快车系列答案
阅读快车系列答案| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | △H1 | |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | △H2 |
②实验测得的温度是:A的起始温度为13.0℃、终了温度为19.8℃;设充分反应后溶液的比热容c=4.184J/(g•℃),忽略实验仪器的比热容及溶液体积的变化,则△H1=-56.9kJ/mol.(已知溶液密度均为1g/cm3)

下列有关说法不正确的是( )
| A. | 上述反应的原子利用率可达到100% | |
| B. | 在核磁共振氢谱中对羟基扁桃酸应该有8个吸收峰 | |
| C. | 对羟基扁桃酸可以发生加成反应、取代反应和缩聚反应 | |
| D. | 1 mol对羟基扁桃酸与足量NaOH溶液反应,消耗3mol NaOH |
| A. | 38 | B. | 32 | C. | 99 | D. | 166 |
| A. | 铯与水反应比钠更加剧烈 | |
| B. | 原子最外层都只有一个电子 | |
| C. | 锂燃烧生成Li2O | |
| D. | 钾可以将氯化钠溶液中的钠置换出来 |
(1)第三周期元素中,钠原子核外有4种能量不同的电子;氯原子的最外层电子排布式为3S23p5;由这两种元素组成的化合物的电子式为
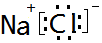 .
.(2)下列气体能用浓硫酸干燥的是CD.
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱与盐酸反应,钠的反应速率大,镁的反应速率慢.
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时可分解生成两种盐,化学方程式为:KClO3$\stackrel{400℃}{→}$ KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为3:1.
(5)已知:
| 化合物 | MgO | MgCl2 |
| 类型 | 离子化合物 | 离子化合物 |
| 熔点/℃ | 2800 | 714 |
| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | 卤族元素的最高正化合价等于其主族序数 | |
| C. | 元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 | |
| D. | Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 |
| A. | 氧化性:Fe3+>Cu2+>Fe2+>Zn2+ | B. | 还原性:Fe3+>Cu2+>Fe2+>Zn2+ | ||
| C. | 氧化性:Zn>Fe>Cu>Fe2+ | D. | 还原性:Zn>Fe>Cu>Fe2+ |
 钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:
钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题: