题目内容
2.在100mL 0.1mol•L-1的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度也增大,可采用的方法是( )| A. | 升高一定的温度 | |
| B. | 加入100 mL 0.1 mol•L-1的醋酸溶液 | |
| C. | 加入少量的0.5 mol•L-1的硫酸 | |
| D. | 加入少量的1 mol•L-1的NaOH溶液 |
分析 醋酸是弱电解质,弱电解质的电离是吸热反应,升高温度促进其电离,氢离子浓度增大,加酸抑制醋酸的电离,加氢氧化钠促进醋酸的电离,据此分析.
解答 解:A.醋酸是弱电解质,醋酸的电离是吸热反应,升高温度促进醋酸电离,氢离子浓度增大,所以符合条件,故A正确;
B.向溶液中加入相同浓度的醋酸溶液,氢离子浓度不变,所以不符合条件,故B错误;
C.向溶液中加入少量硫酸,氢离子浓度增大,抑制醋酸电离,电离程度减小,所以不符合条件,故C错误;
D.向溶液中加入少量氢氧化钠溶液,氢氧根离子和氢离子反应,所以促进醋酸电离,且氢离子浓度降低,故D错误;
故选A.
点评 本题考查了弱电解质的电离,既要考虑促进醋酸电离又要考虑氢离子浓度增大,根据外界条件对其影响分析解答即可,难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
12.为了社会可持续发展,化工生产过程应尽量减少对环境的副作用.“绿色化学”是当今社会提出的一个新概念,它要求从经济、环保和技术上设计可行的化学反应.由单质铜制取硝酸铜的下列衍变关系可行且符合“绿色化学”的是( )
| A. | Cu$\stackrel{{H}_{2}S{O}_{4}}{→}$CuSO4$\stackrel{Ba(N{O}_{3})_{2}}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{{O}_{2}}{→}$CuO$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 | |
| C. | Cu$\stackrel{{O}_{2}}{→}$CuO$\stackrel{{H}_{2}O}{→}$Cu(OH)2$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 | |
| D. | Cu$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 |
13.向0.1mol•L-1的CH3COOH溶液中分别加水或加入少量CH3COONa晶体时,下列有关叙述正确的是( )
| A. | 都能使溶液的pH增加 | |
| B. | 都能使溶液的导电性增强 | |
| C. | 溶液中c(H+)•c(OH-)增大 | |
| D. | 都能使溶液中$\frac{c(CHCO{O}^{-})}{c(CHCOO{H}^{+})}$比值减小 |
10.现有常温下的四份溶液:①0.01mol/L 醋酸溶液;②0.01mol/L盐酸;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 将②、③混合,若有pH=7,则消耗溶液的体积:②<③ | |
| C. | 将①、④混合,若有c(CH3COO-)>c(H+),则c(OH-)>c(Na+) | |
| D. | 将四份溶液分别稀释100倍后,溶液的pH:③>④,①>② |
14.下列实验操作中不正确的是( )
| A. | 给烧杯中的液体加热时,不需垫石棉网 | |
| B. | 用药匙或者纸槽把粉末状药品送人试管的底部 | |
| C. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 | |
| D. | 给试管中的液体加热时管口不要对着白己和别人,以免液体暴沸伤人 |
12.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向稀的苯酚水溶液中滴加饱 和溴水 | 生成白色沉淀 | 产物三溴苯酚溶于水 |
| C | 向含I-的无色溶液中滴加少量铁盐溶液,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Fe3+>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
 ;Z2X4结构式
;Z2X4结构式 .
.

 .
. 生成A的化学方程式为
生成A的化学方程式为 +HCHO.
+HCHO. +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.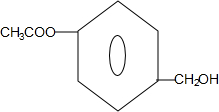 (任写一种结构简式).
(任写一种结构简式). 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.