题目内容
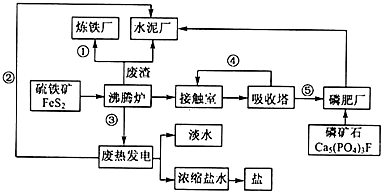
4.利用废铅蓄电池的铅泥(PbO、Pb及PbSO4)可制备精细无机化工产品3PbO•PbSO4•H2O(三盐),主要制备流程如下:下列说法不正确的是( )
| A. | 步級①PbSO4转化为难溶PbCO3的离子方程式为CO32-+PbSO4=PbCO3+SO42- | |
| B. | 步骤③酸溶时,PbO、Pb、PbCO3都与硝酸反应生成Pb(NO3)2; 滤液2中可回收再利用的主要成分为HNO3 | |
| C. | 滤液1、滤液3中所含的溶质完全相同 | |
| D. | 步骤⑥合成三盐的化学方程式为4PbSO4+6NaOH=3Na2SO4+3PbO•PbSO4•H2O+2H2O |
分析 向铅泥中加入Na2CO3溶液,PbSO4转化为难溶PbCO3的离子方程式为CO32-+PbSO4=PbCO3+SO42-,然后过滤得到滤液1为Na2SO4溶液,向滤渣中加入硝酸酸溶,PbO、Pb、PbCO3都与硝酸反应生成Pb(NO3)2,Pb与硝酸反应还生成NO,铅与硝酸生成Pb(NO3)2及NO的离子方程式为3Pb+8H++2NO3-=3Pb+2NO↑+4H2O,然后向溶液中加入硫酸,生成bSO4沉淀,过滤,滤液2的主要成分是HNO3,向滤渣中加入NaOH溶液,发生反应4PbSO4+6NaOH=3Na2SO4+3PbO•PbSO4•H2O+2H2O,过滤洗涤干燥得到3PbO•PbSO4•H2O,滤液3中含有Na2SO4,以此解答该题.
解答 解:向铅泥中加入Na2CO3溶液,PbSO4转化为难溶PbCO3的离子方程式为CO32-+PbSO4=PbCO3+SO42-,然后过滤得到滤液1为Na2SO4溶液,向滤渣中加入硝酸酸溶,PbO、Pb、PbCO3都与硝酸反应生成Pb(NO3)2,Pb与硝酸反应还生成NO,铅与硝酸生成Pb(NO3)2及NO的离子方程式为3Pb+8H++2NO3-=3Pb+2NO↑+4H2O,然后向溶液中加入硫酸,生成bSO4沉淀,过滤,滤液2的主要成分是HNO3,向滤渣中加入NaOH溶液,发生反应4PbSO4+6NaOH=3Na2SO4+3PbO•PbSO4•H2O+2H2O,过滤洗涤干燥得到3PbO•PbSO4•H2O,滤液3中含有Na2SO4,
A.碳酸钠和硫酸铅发生难溶物的转化,离子方程式为CO32-+PbSO4=PbCO3+SO42-,故A正确;
B.由以上分析可知,滤液2的主要成分是HNO3,可回收利用,故B正确;
C.滤液1主要成分为Na2SO4,含有少量Na2CO3,滤液2主要成分为Na2SO4,含有少量NaPOH,不完全相同,故C错误;
D.由题意可知,步骤⑥合成三盐的化学方程式为4PbSO4+6NaOH=3Na2SO4+3PbO•PbSO4•H2O+2H2O,故D正确.
故选C.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析及知识综合应用能力,涉及基本操作、氧化还原反应、离子反应等知识点,明确流程图中发生的反应或操作方法是解本题关键,注意基础知识的积累和灵活运用,题目难度中等.

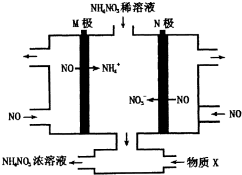
| A. | M极连接直流电源的正极 | |
| B. | 阳极上的电极反应为:NO-3e-+4OH-=NO3-+2H2O | |
| C. | 为使电解产物全部转化为NH4NO3浓溶液,需补充的物质X,则X为NH3 | |
| D. | 装置中加入稀NH4NO3溶液的目的是为了提高溶液的导电能力,可用NaNO3溶液代替 |
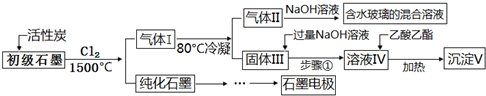
(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)下列说法不正确的是( )
| A. | 向反应器中通入Cl2前,需通一段时间N2,主要目的是排除空气,减少碳的损失 | |
| B. | 在1500℃高温条件下,反应后初级石墨中的氧化物杂质均转变为相应的氯化物和CO2 | |
| C. | 步骤①为:搅拌、过滤,所得溶液IV中的阴离子有Cl-、OH-、AlO2? | |
| D. | 100 g初级石墨最多可获得V的质量为7.8 g |
| A. | 2:7 | B. | 7:15 | C. | 3:8 | D. | 1:5 |

| A. | 最高正化合价:Z>X | |
| B. | X、Y、Z的单质中,Z单质的熔点最高 | |
| C. | 若X为非金属元素,则离子半径:Xn->Ym->Zm- | |
| D. | X最高价氧化物对应的水化物,要么是强酸,要么是强碱 |
| A. | 鼓励使用太阳能、风能等淸洁能源能减少PM2.5的污染 | |
| B. | 用含有橙色酸性K2Cr207的仪器检验酒驾,利用了乙醇的挥发性和氧化性 | |
| C. | 粮食酿酒的制造原理为淀粉水解变成葡萄糖,葡萄糖再水解得到酒精 | |
| D. | 与铜质水龙头连接处的钢质水管易发生析氢腐蚀 |
| A. | HCl易溶于水 | B. | I2可溶于水 | C. | Cl2可溶于水 | D. | CO2可溶于水 |

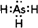 .
.