题目内容
14.高锰酸钾和氢溴酸溶液可以发生反应,请配平方程式:KMnO4+HBr→Br2+MnBr2+KBr+H2O,其中还原剂是HBr.若消耗15.8g氧化剂,则被氧化的还原剂的物质的量是0.5mol.分析 反应KMnO4+HBr→Br2+MnBr2+KBr+H2O中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,然后根据氧化还原反应中化合价升降相等配平;氧化还原反应中氧化剂和还原剂之间得失电子数目相等,据此计算出消耗15.8g氧化剂,则被氧化的还原剂的物质的量.
解答 解:反应KMnO4+HBr→Br2+MnBr2+KBr+H2O中,Br元素化合价升高,Mn元素化合价降低,
则反应中KMnO4为氧化剂,HBr为还原剂;
Mn元素化合价由+7→+2价,变化5价,Br元素化合价由-1价→0价,变化1价,至少升高2价,氧化还原反应中化合价升降相等,则化合价变化的最小公倍数为10,则高锰酸钾的计量数为:$\frac{10}{5}$=2,溴单质的计量数为:$\frac{10}{2}$=5,然后利用观察法配平可得:2 KMnO4+16HBr→5Br2+2MnBr2+2KBr+8H2O;
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,设被氧化的还原剂的物质的量是x,
15.8gKMnO4的物质的量为:$\frac{15.8g}{158g/mol}$=0.1mol,
则有:0.1mol×(7-2)=x×(1-0),
解得:x=0.5mol,
故答案为:2 KMnO4+16HBr→5Br2+2MnBr2+2KBr+8H2O;HBr;0.5.
点评 本题考查氧化还原反应的计算,题目难度中等,明确氧化还原反应的实质为解答关键,计算时注意氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相等.

练习册系列答案
相关题目
5.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O $?_{充电}^{放电}$ Cd(OH)2+2Ni(OH)2,下列叙述中正确的是( )
| A. | 该电池放电的时候,负极材料是Ni(OH)2 | |
| B. | 放电时每转移3mol的电子时,正极有3mol的NiO(OH)被氧化 | |
| C. | 充电时,阴极附近PH增大 | |
| D. | 充电时,阳极反应是Cd(OH)2+2e-=Cd+2 OH- |
9.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入稀盐酸无明显现象,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ |
19.下列有“国防金属”美誉之称的是( )
| A. | 铁 | B. | 金 | C. | 铝 | D. | 镁 |
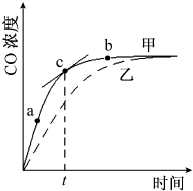 ①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是CD.
①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是CD.
 .
.