题目内容
20.恒温、恒压下,1molA和1molB在一个容积可变的容器中发生如下反应:A(g)+2B(g)?2C(g).一段时间后达到平衡,生成amolC,下列说法不正确的是( )| A. | 物质A、B的转化率之比一定是1:2 | |
| B. | 当气体的密度不再变化时,可断定反应达到平衡 | |
| C. | 若起始放入3molA和3molB,则达平衡时生成3amolC | |
| D. | 当v正(A)=v逆(C)时,可断定反应达到平衡 |
分析 A.A、B的起始量都是1mol,所以A、B的转化率之比等于参加反应的物质的物质的量之比;
B.起始时刻和达平衡后容器体积不等,则密度不等;
C.在恒压下,放入3molA和3nmolB,与起始时1molA和nmolB配比数相等,为等效平衡;
D.反应达平衡时,正逆反应速率相等,根据速率之比等于化学计量数之比判断.
解答 解:A.A、B的起始量都是1mol,所以A、B的转化率之比等于参加反应的物质的物质的量之比,根据反应方程式可知,物质A、B的转化率之比一定是1:2,故A正确;
B.在恒压下,随着反应的进行,气体的物质的量逐渐减小,则容器的体积逐渐减小,起始时刻和达平衡后容器体积不等,则密度不等,当气体的密度不再变化时,可断定反应达到平衡,故B正确;
C.在恒压下,放入3molA和3nmolB,与起始时1molA和nmolB配比数相等,为等效平衡,则达平衡时生成3amolC,故C正确;
D.当2v正(A)=v逆(C)时,正逆反应速率相等,反应达到平衡状态,故D错误.
故选D.
点评 本题综合考查化学平衡问题,为高考常见题型和高频考点,侧重考查平衡标志的判断,转化率、及等效平衡问题,题目难度不大,注意反应在恒压条件下进行的状态.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
8.下列各项操作中,能出现“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2 ②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀氢氧化钠溶液 ④向硅酸钠溶液中逐滴加入过量的盐酸.
①向饱和碳酸钠溶液中通入过量的CO2 ②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀氢氧化钠溶液 ④向硅酸钠溶液中逐滴加入过量的盐酸.
| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①③ |
5.下列物质的俗称表示同一物质的是( )
| A. | 明矾、胆矾 | B. | 冰、干冰 | C. | 火碱、烧碱 | D. | 苏打、小苏打 |
12.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 常温常压下,22.4LH2O中含有的氢原子数为2NA | |
| B. | 17gNH3与18 g H2O所含有电子数均为10NA | |
| C. | 2.7 g Al与足量的NaOH溶液反应,生成H2的分子数为0.1NA | |
| D. | 1 mol HCl气体中的分子数与2L 0.5 mol/L盐酸中的溶质粒子数相等 |
9.在炼钢、制玻璃、制水泥三种工业生产中,都需要的原料是( )
| A. | 纯碱 | B. | 石灰石 | C. | 石英 | D. | 黏土 |
1.同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是( )
| A. | 2Na218O2+2CO2═2Na2Cl8O3+O2 | |
| B. | NH4Cl+2H2O?NH3•H2O+HCl | |
| C. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O | |
| D. | 2KMnO4+5H218O2+3H2SO4═K2SO4+2MnSO4+518O2↑+8H2O |

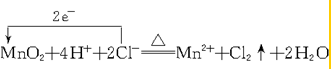 .
.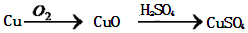 .
.