题目内容
【题目】已知2A2(g)+B2(g)![]() 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度___(填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系:Q3=____________。

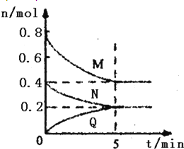
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____________;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容容器,起始时加入4 molA2和2 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2__________Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是___________(填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
【答案】![]() 不变=Q1-Q2ad<b
不变=Q1-Q2ad<b
【解析】
(1)2A2(g)+B2(g)2C3(g);△H=-Q1 kJ/mol(Q1>0),达平衡后C3的浓度为w molL-1,放出热量为Q2 kJ,达到平衡时,A2的转化率为![]() ;
;
(2)达到平衡后,若向原容器中通入少量的氩气,氩气不参与反应,A2的转化率不变;
(3)正反投2molA2和1molB2,与逆向投2molC3,是等效平衡,所以反应达平衡后,C3浓度等于 w mol/L,2A2(g)+B2(g)![]() 2C3(g),2A2(g)+B2(g)
2C3(g),2A2(g)+B2(g)![]() 2C3(g),根据盖斯定律知:Q1=Q2+Q3;
2C3(g),根据盖斯定律知:Q1=Q2+Q3;
(4)a.从左往右增加B2的物质的量反应体系中各物质的浓度变大,反应速率c>b>a,故选;b.B2的物质的量越大A2的转化率越大,从左往右增加B2的物质的量,达到平衡时A2的转化率大小为:c>b,故不选;c.在B2相同时,从下往上,C3平衡时的体积分数变大,平衡正向移动,正反应是放热反应,所以温度降低,温度的大小关系是T2<T1,故不选;d.b点A2和B2的物质的量之比为2:1,与起始浓度之比相同,故选;故答案为:ad;
(5)恒压条件下,相当给原平衡加压,由于始终保持较大压强,平衡正向移动,转化率变大,Q2<Q4;
(6)a.选择适当的催化剂,平衡不移动,B2的转化率不变;故不选;b.增大压强,反应速率增大,平衡向正反应分析移动,B2的转化率增大,故选;c.及时分离生成的C3,反应速率减小,故不选;d.升高温度平衡向逆反应分析移动,B2的转化率减小,故不选;故答案为:b。

 阅读快车系列答案
阅读快车系列答案