题目内容
1.据报道,美国正在研究的锌电池可能取代目 前广泛使用的铅蓄电池,它具有容量大等优点,其电池反应为2Zn+O2═2ZnO,原料是锌粒、电解质溶液、空气.下列叙述中正确的是( )| A. | Zn为正极 | B. | 负极反应式:O2+4H++4e-→2H2O | ||
| C. | 正极发生氧化反应 | D. | 电解液肯定不是强酸 |
分析 根据化合价变化可知Zn被氧化,作原电池的负极,负极上锌失电子发生氧化反应,正极上氧气得电子发生还原反应,结合物质的性质分析.
解答 解:A、电池反应为2Zn+O2═2ZnO,锌失去电子化合价升高,发生氧化反应作原电池负极,故A错误;
B、锌失去电子化合价升高,发生氧化反应作原电池负极,O2在正极上得电子,发生还原反应,即氧气得电子和水反应生成氢氧根离子,故B错误;
C、正极上得电子发生还原反应,故C错误;
D.氧化锌能溶于酸,所以电解质溶液一定不是强酸,故D正确;
故选D.
点评 本题考查了原电池知识,题目难度不大,注意根据电池反应判断原电池的正负极以及电极反应.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
14.X、Y是短周期元素,两者能形成化合物X2Y3,已知X的核电荷数为n,则Y的核电荷数不可能是( )
| A. | n+11 | B. | n+1 | C. | n+3 | D. | n+4 |
16.下列物质中,与0.3mol H2O含有相同氢原子数的物质是( )
| A. | 18.9 g HNO3 | B. | 3.612×1024个HCl分子 | ||
| C. | 0.2 mol H3PO4 | D. | 0.2 NA个CH4分子 |
6.由铜、锌和稀硫酸组成的原电池中,下列各叙述正确的是( )
| A. | 溶液pH由大变小 | B. | 负极附近Zn2+浓度逐渐增大 | ||
| C. | H+向负极移动 | D. | 溶液中H2SO4的浓度不变 |
11.标准状况下,1mol下列物质体积最大的是( )
| A. | Fe | B. | O2 | C. | H2O | D. | H2SO4 |
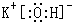 (填写电子式);
(填写电子式);