题目内容
4.已知元素X、Y同周期,且电负性X>Y,下列说法错误的是( )| A. | X的原子序数一定大于Y | |
| B. | 第一电离能Y一定小于X | |
| C. | X和Y在形成化合物时,X显负价、Y显正价 | |
| D. | 气态氢化物的稳定性:HmX强于HnY |
分析 A.同周期元素,自左而右元素的电负性增强,电负性X>Y,故原子序数X>Y;
B.若Y的第一电离能失去的电子所处能级为半满稳定状态,其第一电离能可能高于X的第一电离能;
C.电负性表示原子对键合电子吸引的大小,电负性越大的原子,对键合电子的吸引力越大;
D.非金属性越强,氢化物越稳定.
解答 解:A.同周期元素,自左而右元素的电负性增强,电负性X>Y,故原子序数X>Y,故A正确;
B.若Y的第一电离能失去的电子所处能级为半满稳定状态,其第一电离能可能高于X的第一电离能,如电负性S>P,但第一电离能P>S,故B错误;
C.电负性表示原子对键合电子吸引的大小,电负性越大的原子,对键合电子的吸引力越大,电负性X>Y,键合电子偏向X原子,偏离Y原子,故X与Y形成化合物中,X显负价,Y显正价,故C正确;
D.非金属性越强,最高价含氧酸的酸性越强,同周期自左而右元素的非金属性增强,故非金属性X>Y,所以氢化物的稳定性:HmX强于HnY,故D正确;
故选B.
点评 本题考查同种元素性质递变规律、电离能、电负性等,题目难度不大,注意B中第一电离能的特殊性.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
14.下列关于苯酚的说法正确的是( )
| A. | 常温下,苯酚易溶于水 | |
| B. | 苯酚俗称石炭酸,具有微弱的酸性,能与碳酸钠溶液反应 | |
| C. | 纯净的苯酚是粉红色晶体 | |
| D. | 洒落皮肤上的苯酚可以用氢氧化钠稀溶液洗涤 |
12.下列元素中,原子半径最大的是( )
| A. | 锂 | B. | 钠 | C. | 氟 | D. | 氯 |
19.下列物质中,不能用作漂白剂的是( )
| A. | SO2 | B. | Ca(ClO)2 | C. | NaClO | D. | HCl |
9.与CO32-不是等电子体的是( )
| A. | SO3 | B. | BF3 | C. | NO3- | D. | PCl3 |
16.下列叙述能证明金属A的金属性比金属B强的是( )
| A. | A原子的最外层电子数比B原子最外层电子数少 | |
| B. | 常温下,A能从冷水中置换出氢气,而B不能 | |
| C. | 等物质的量A和B与足量稀硫酸反应,产生氢气的量A比B多 | |
| D. | A原子的电子层数比B原子电子层数多 |
13.下列有关物质的表达式正确的是( )
| A. | 乙烯的结构简式:CH2 CH2 | B. | 丙烯的球棍模型: | ||
| C. | 醛基的结构简式:-COH | D. | 羟基的电子式: |
 ,系统命名法命名为2,2,4,4-四甲基戊烷
,系统命名法命名为2,2,4,4-四甲基戊烷 ,系统命名法命名为2,2,3,3-四甲基戊烷
,系统命名法命名为2,2,3,3-四甲基戊烷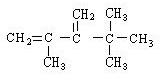 .
.