题目内容
2.A、B为同周期的两主族元素,若A的原子序数为n,则B的原子序数不可能为( )| A. | n-4 | B. | n+8 | C. | n-12 | D. | n+26 |
分析 A、除第-周期外的其它周期主族元素任意连续五种元素,都符合n-4;
B、因为过渡元素最少有10种元素,所以不可能n+8;
C、第四、五周期跨过渡元素的主族元素符合n-12;
D、第六、七周期跨过渡元素的主族元素符合n+26;
解答 解:A、除第-周期外的其它周期主族元素任意连续五种元素,都符合n-4,如铝与氯,故A不选;
B、因为过渡元素最少有10种元素,所以不可能n+8,故B选;
C、第四、五周期跨过渡元素的主族元素符合n-12,如32号的锗与20号钙,故C不选;
D、第六、七周期跨过渡元素的主族元素符合n+26,如55 铯和81的铊,故D不选;
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期中元素的种类数及同周期原子序数的关系为解答的关键,注意同主族元素不一定相邻,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
7.工业上以锂辉石(Li2O•A12O3•4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂.其部分工艺流程如下:
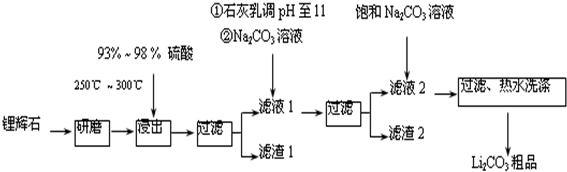
已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②某些物质的溶解度(S)如表所示.
(1)从滤渣1中分离出Al2O3的部分流程如图所示,括号表示加入的试剂,方框表示所得到的物质.则步骤Ⅱ中反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
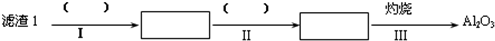
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.
向滤液1中加入石灰乳的作用是(运用化学平衡移动原理解释)增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出.
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3=Li2CO3+NH3+2H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②某些物质的溶解度(S)如表所示.
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
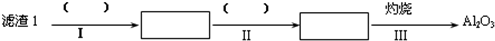
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.
向滤液1中加入石灰乳的作用是(运用化学平衡移动原理解释)增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出.
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3=Li2CO3+NH3+2H2O.
11.下列反应中,属于吸热反应的是( )
| A. | 硝酸铵溶于水 | B. | 氢气在氯气中燃烧 | ||
| C. | 盐酸和氢氧化钠溶液反应 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
12.可逆反应H2(g)+I2(g)?2HI(g)达到平衡时的标志是( )
| A. | H2、I2、HI的浓度相等 | |
| B. | 混合气体密度恒定不变 | |
| C. | 混合气体的质量不再改变 | |
| D. | 1个I-I键断裂的同时,有2个H-I键断裂 |