题目内容
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数数值分别为:
下列有关叙述正确的是( )
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A、上述反应的正反应是吸热反应 | ||||
B、该反应的化学方程式是:CO2(g)+H2(g)
| ||||
C、某温度下,如果平衡浓度符合下列关系式:
| ||||
| D、如果在一定体积的密闭容器中加入CO2和H2各1mol,5min后温度升高到830℃,测得CO为0.4 mol时,该反应为平衡状态 |
分析:A、根据温度升高,平衡常数减小进行,平衡向着逆向移动判断该反应焓变;根据温度对化学平衡和反应速率的影响进行判断;
B、根据化学平衡常数表达式判断,化学平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
C、将该温度下,关系式带入化学平衡常数表达式,进行判断;
D、设达到平衡时一氧化碳的浓度为x,根据平衡常数表达式列式计算出x,再反应到达平衡时CO的物质的量浓度,进行比较.
B、根据化学平衡常数表达式判断,化学平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
C、将该温度下,关系式带入化学平衡常数表达式,进行判断;
D、设达到平衡时一氧化碳的浓度为x,根据平衡常数表达式列式计算出x,再反应到达平衡时CO的物质的量浓度,进行比较.
解答:解:A、根据表中数据可知,温度升高,平衡常数减小,说明升高温度平衡向着逆向移动,所以正反应为放热反应,故A错误;
B、化学平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,因此反应物为CO和H2O,生成物为CO2和H2,计量数均为1,化学方程式可写为:CO(g)+H2O(g)
CO2(g)+H2(g),故B错误;
C、由于
=
,整理化简可得:K=
=
=0.6,温度为1000℃,故C正确;
D、设平衡时CO的物质的量为x,体积一定可以用物质的量进行计算,
CO2(g)+H2(g)?CO(g)+H2O(g)
起始浓度(mol) 1 1 0 0
转化浓度(mol) x x x x
平衡浓度(mol) (1-x)(1-x) x x
则K=
=
=1.00
解得:x=0.5mol,即平衡时n(CO)=0.5 mol,故D错误;
故选C.
B、化学平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,因此反应物为CO和H2O,生成物为CO2和H2,计量数均为1,化学方程式可写为:CO(g)+H2O(g)
| 高温 |
| 催化剂 |
C、由于
| c(CO2) |
| 3c(CO) |
| c(H2O) |
| 5c(H2) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 3 |
| 5 |
D、设平衡时CO的物质的量为x,体积一定可以用物质的量进行计算,
CO2(g)+H2(g)?CO(g)+H2O(g)
起始浓度(mol) 1 1 0 0
转化浓度(mol) x x x x
平衡浓度(mol) (1-x)(1-x) x x
则K=
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| x2 |
| (1-x)2 |
解得:x=0.5mol,即平衡时n(CO)=0.5 mol,故D错误;
故选C.
点评:本题考查了化学平衡的影响因素、化学平衡常数的概念及应用、化学平衡的计算,题目难度中等,注意明确化学平衡的影响因素,掌握利用三段式进行化学平衡的计算方法.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
(2012?松江区一模)已知某化学反应的平衡常数表达式为K=
|
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数如下表:
下列有关叙述不正确的是( )
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A、该反应的化学方程式是CO(g)+H2O(g)═CO2(g)+H2(g) | ||||
| B、上述反应的正反应是放热反应 | ||||
| C、若在一定体积的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态 | ||||
D、若平衡浓度符合下列关系式:
|
已知某化学反应的平衡常数表达式为K=![]()
![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A.该反应的化学方程式是:CO(g)+![]() (g)
(g)![]()
![]()
B.上述反应的正反应是放热反应.
C.如果在一定体积的密闭容器中加入![]() 和
和![]() 各1 mol,5 min后温度升高到
各1 mol,5 min后温度升高到
830℃,此时测得![]() 为0.4 mol时,该反应为平衡状态。
为0.4 mol时,该反应为平衡状态。
D.某温度下,如果平衡浓度符合下列关系式:![]() ,判断此时的温度是1000℃.
,判断此时的温度是1000℃.
已知某化学反应的平衡常数表达式为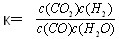 ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
1.67 |
1.11 |
1.00 |
0.60 |
0.38 |
有关叙述错误的是
A.该反应的化学方程式是:CO(g)+H2O(g) 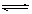 CO2(g)+H2(g)
CO2(g)+H2(g)
B.该反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO和H2O各1 mol,再把温度升高到830 ℃,此时测得CO2为0.4 mol时,这时可逆反应处于平衡状态
D.若平衡浓度关系符合 =
=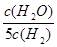 ,可判断此时温度是1000 ℃
,可判断此时温度是1000 ℃