题目内容
已知某化学反应的平衡常数表达式为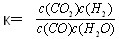 ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
1.67 |
1.11 |
1.00 |
0.60 |
0.38 |
有关叙述错误的是
A.该反应的化学方程式是:CO(g)+H2O(g) 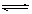 CO2(g)+H2(g)
CO2(g)+H2(g)
B.该反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO和H2O各1 mol,再把温度升高到830 ℃,此时测得CO2为0.4 mol时,这时可逆反应处于平衡状态
D.若平衡浓度关系符合 =
=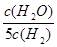 ,可判断此时温度是1000 ℃
,可判断此时温度是1000 ℃
【答案】
C
【解析】A:由平衡常数表达式可看出,产物CO2(g)、H2(g)和反应物CO(g)、H2O(g)系数均为1,则化学方程式是:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
B:随温度升高,K减小,即平衡左移,正反应是放热反应。
C:由方程式可计算出此时 =4/9<1,所以并没有处于在平衡状态。
=4/9<1,所以并没有处于在平衡状态。
D:由 导出
导出 为0.6,结合表格数据可知此时温度是1000 ℃
为0.6,结合表格数据可知此时温度是1000 ℃
故选项C描述错误

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(2012?松江区一模)已知某化学反应的平衡常数表达式为K=
|
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数数值分别为:
下列有关叙述正确的是( )
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A、上述反应的正反应是吸热反应 | ||||
B、该反应的化学方程式是:CO2(g)+H2(g)
| ||||
C、某温度下,如果平衡浓度符合下列关系式:
| ||||
| D、如果在一定体积的密闭容器中加入CO2和H2各1mol,5min后温度升高到830℃,测得CO为0.4 mol时,该反应为平衡状态 |
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数如下表:
下列有关叙述不正确的是( )
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A、该反应的化学方程式是CO(g)+H2O(g)═CO2(g)+H2(g) | ||||
| B、上述反应的正反应是放热反应 | ||||
| C、若在一定体积的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态 | ||||
D、若平衡浓度符合下列关系式:
|
已知某化学反应的平衡常数表达式为K=![]()
![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A.该反应的化学方程式是:CO(g)+![]() (g)
(g)![]()
![]()
B.上述反应的正反应是放热反应.
C.如果在一定体积的密闭容器中加入![]() 和
和![]() 各1 mol,5 min后温度升高到
各1 mol,5 min后温度升高到
830℃,此时测得![]() 为0.4 mol时,该反应为平衡状态。
为0.4 mol时,该反应为平衡状态。
D.某温度下,如果平衡浓度符合下列关系式:![]() ,判断此时的温度是1000℃.
,判断此时的温度是1000℃.