题目内容
9.用芒硝(Na2SO4•10H2O)制备纯碱、氨明矾[NH4Al(SO4)2•12H2O]的生产工艺流程如图所示:(已知:碳酸氢铵极易受热分解;碳酸氢钠的溶解度较小)
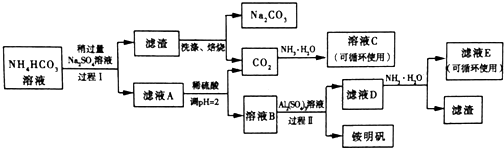
(1)溶液C中的主要溶质是NH4HCO3
(2)请写出将少量的氨明矾的水溶液滴加到Ba(OH)2溶液中反应的离子反应方程式NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+NH3•H2O+AlO2-+2H2O
(3)过程 I中的反应温度不能超过40℃,其原因是NH4HCO3易受热分解.
(4)运用化学平衡原理解释Na2SO4溶液稍过量的原因:HCO32-(aq)+Na+(aq)?NaHCO3(s),Na+浓度增大平衡向正反应方向移动.
(5)溶液E中的溶质离子为NH4+、SO42-
(6)已知氨明矾的溶解度随着温度的升高而增大,过程 II中得到氨明矾的系列实验操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
分析 碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与溶液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及溶解的NH4HCO3,加入硫酸,调节pH使NH4HCO3转化二氧化碳与(NH4)2SO4 ,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾,D主要为剩余的NH4HSO4、Al2(SO4)3,
(1)CO2与氨水反应生成NH4HCO3或(NH4)2CO3,溶液C可以循环使用可以判断为碳酸氢铵;
(2)少量的氨明矾的水溶液滴加到Ba(OH)2溶液中反应,铵明矾中离子全部反应生成一水合氨、硫酸钡和偏铝酸钡,结合电荷守恒和原子守恒配平书写得到离子方程式;
(3)NH4HCO3易受热分解;
(4)在平衡体系中增加一种反应物的浓度,反应正向进行,提高另外反应物的转化率;
(5)A为(NH4)2SO4和剩余的硫酸盐和碳酸盐,B主要为NH4HSO4,D主要为剩余的NH4HSO4、Al2(SO4)3,E为(NH4)2SO4;
(6)明矾铵的溶解度随着温度的升高而增大,故采用降温结晶的方法分离,因滤液浓度低,所以需要浓缩;
解答 解:碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与溶液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及溶解的NH4HCO3,加入硫酸,调节pH使NH4HCO3转化二氧化碳与(NH4)2SO4 ,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾,D主要为剩余的NH4HSO4、Al2(SO4)3.
(1)CO2与氨水反应生成NH4HCO3或(NH4)2CO3,溶液C可以循环使用可以判断为碳酸氢铵,
故答案为:NH4HCO3;
(2)少量的氨明矾的水溶液滴加到Ba(OH)2溶液中反应,铵明矾中离子全部反应生成一水合氨、硫酸钡和偏铝酸钡,结合电荷守恒和原子守恒配平离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+NH3•H2O+AlO2-+2H2O,
故答案为:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+NH3•H2O+AlO2-+2H2O:
(3)NH4HCO3易受热分解,故反应应控制温度不能超过40℃,
故答案为:NH4HCO3易受热分解;
(4)在平衡体系中增加一种反应物的浓度,反应正向进行,提高另外反应物的转化率,HCO32-(aq)+Na+(aq)?NaHCO3(s),Na+浓度增大平衡向正反应方向移,故答案为:HCO32-(aq)+Na+(aq)?NaHCO3(s),Na+浓度增大平衡向正反应方向移动;
(5)A为(NH4)2SO4和剩余的硫酸盐和碳酸盐,B主要为NH4HSO4,D主要为剩余的NH4HSO4、Al2(SO4)3,E为(NH4)2SO4,溶液E中的溶质离子为:NH4+、SO42-,故答案为:NH4+、SO42-;
(6)明矾铵的溶解度随着温度的升高而增大,故采用降温结晶的方法分离,因滤液浓度低,所以需要浓缩,方法为蒸发浓缩、降温结晶(冷却结晶),故答案为:蒸发浓缩;蒸发浓缩,冷却结晶.
点评 本题考查制备实验方案设计、物质组成的测定,明确工艺流程原理是解题关键,综合考查学生分析解决问题的能力,题目难度中等.

| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 原子核外电子有4种不同的运动状态 |
| C | 元素原子的核外成对电子数是未成对电子数的2倍且有3个能级 |
| D | 元素原子的核外p电子数比s电子数少1 |
| E | E原子的第一至第四电离能如下:I1=738 kJ•mol-1 I2=1451 kJ•mol-1 I3=7733 kJ•mol-1 I4=10540 kJ•mol-1 |
| F | 第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满 |
(1)F位于元素周期表第IB族,其简化电子排布式为[Ar]3d104s1 .
(2)D元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断E基态原子的核外电子排布图为:
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.(4)A与D形成的D2A4分子中D原子的杂化类型为sp3杂化,A与D形成的最简单分子易溶于水的原因氨气分子能与水分子形成氢键.
(5)C的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1).则1个这种单质分子中所含π键的数目为30.

(6)已知在元素周期表中存在“对角线规则”,即周期表中左上方与右下方元素它们的单质及其化合物的性质相似,如Li和Mg,试写出向BeCl2溶液中加入过量的NaOH溶液反应的化学方程式:BeCl2+4NaOH═Na2BeO2+2NaCl+2H2O.
(7)图2是金属Ca和F所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=5(填数值);氢在合金中的密度为0.083g•cm-3.
| A. | 0个 | B. | 2个 | C. | 3个 | D. | 4个 |
| A. | 决定化学反应速率的主要因素是光照、超声波、压强和催化剂等 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 | |
| C. | 可逆反应进行到一定程度时,正、逆反应速率相等.各物质浓度也相等 | |
| D. | 生产过程中,化学反应限度是决定原料利用率和产品产率的重要因素之一 |
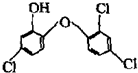 据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )
据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )| A. | 三氯生的分子式为:C12H6Cl3O2 | |
| B. | 哥罗芳存在同分异构体 | |
| C. | 1mol三氯生最多能与4molNaOH溶液反应 | |
| D. | 三氯生遇FeCl3溶液显紫色 |
 和
和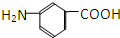 E.35Cl和37Cl
E.35Cl和37Cl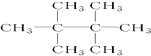 ,
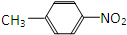
,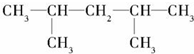 ,该烯烃可能的结构简式有2种.
,该烯烃可能的结构简式有2种.