题目内容
分别用0.20mol?L-1的AgNO3溶液10mL与相同体积的下列溶液恰好完全反应,则物质的量浓度最大的是( )
| A、KCl |
| B、MgCl2 |
| C、BaCl2 |
| D、AlCl3 |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:消耗硝酸银的物质的量相等,则生成AgCl的物质的量相同,据氯离子守恒计算选项中各溶质的物质的量,相同体积物质的量之比等于物质的量浓度之比.
解答:
解:参加反应的AgNO3的物质的量相同,则生成AgCl的物质的量相同,由银离子守恒可知n(AgCl)=n(AgNO3)=0.01mol×0.2mol/L=0.002mol,根据氯离子守恒可知:
n(KCl)=n(AgCl)=0.002mol,
n(MgCl2)=
n(AgCl)=
×0.002mol=0.001mol,
n(BaCl2)=
n(AgCl)=
×0.002mol=0.001mol,
n(AlCl3)=
n(AgCl)=
×0.002mol=0.00067mol,
相同体积物质的量之比等于物质的量浓度之比,故KCl溶液的浓度最大,
故选A.
n(KCl)=n(AgCl)=0.002mol,
n(MgCl2)=
| 1 |
| 2 |
| 1 |
| 2 |
n(BaCl2)=
| 1 |
| 2 |
| 1 |
| 2 |
n(AlCl3)=
| 1 |
| 3 |
| 1 |
| 3 |
相同体积物质的量之比等于物质的量浓度之比,故KCl溶液的浓度最大,
故选A.
点评:本题考查物质的量浓度的有关计算,比较基础,可以根据含有氯离子相等,不需要计算具体的值进行比较.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
向BaCl2溶液中通入SO2没有沉淀产生,但若先加入一种试剂,再通入SO2则仍然没有沉淀生成的是( )
| A、NH3 |
| B、NO2 |
| C、CO2 |
| D、H2S |
为探究NaHCO3、Na2CO3与1mol/L盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:下列有关说法正确的是( )
| 序号 | 液体 | 固体 | 混合前温度 | 混合后最高温度 |
| ① | 35mL水 | 2.5g NaHCO3 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2g Na2CO3 | 20℃ | 24.3℃ |
| ③ | 35mL盐酸 | 2.5g NaHCO3 | 20℃ | 16.2℃ |
| ④ | 35mL盐酸 | 3.2g Na2CO3 | 20℃ | 25.1℃ |
| A、仅通过实验③即可判断反应Ⅰ是吸热反应 |
| B、仅通过实验④即可判断反应Ⅱ是放热反应 |
| C、通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应 |
| D、通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应 |
有一空瓶的质量为W1g,该瓶充入空气后质量为W2g,相同条件下,充入某单质气体,其质量为W3g,则此单质气体的摩尔质量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙).
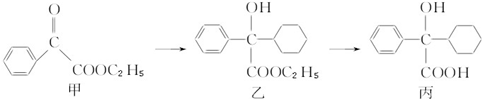
下列说法正确的是( )

下列说法正确的是( )
| A、化合物乙能发生消去反应,且生成的有机物能和Br2发生加成反应 |
| B、化合物丙能和FeCl3溶液发生显色反应 |
| C、化合物甲中的含氧官能团有羰基和酯基 |
| D、化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙 |
下列关于二氧化硫的叙述中错误的是( )
| A、在高温下二氧化硫可被催化氧化成三氧化硫 |
| B、二氧化硫可使品红溶液褪色 |
| C、二氧化硫既具有氧化性又具有还原性 |
| D、二氧化硫与水反应生成硫酸 |
下列反应的离子方程式正确的是( )
| A、NaHCO3溶液与醋酸:CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑ |
| B、硝酸银溶液与铜:Cu+Ag+=Cu2++Ag |
| C、将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O |
| D、盐酸和硅酸钠溶液反应:2H++SiO32-=H2SiO3(胶体) |