题目内容
6.排放的工业废水中含Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑制得Fe2O3、Al2O3和金属Cu,过程如下.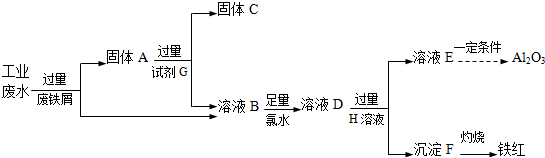
请回答:
(1)固体A的成分是Fe、Cu(填化学式).
(2)溶液B中的金属阳离子有Fe2+、Al3+.
(3)试剂G是稀盐酸或稀硫酸(填名称).
(4)B→D反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-.
(5)溶液E焰色反应呈黄色,试剂H是NaOH溶液.
分析 某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,先加过量铁2Fe3++Fe═3 Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,发生Fe+Cu2+═Cu+2Fe2+,由于铁过量,所以所得固体A包括Fe和Cu,G为稀盐酸或稀硫酸,C为Cu,B为Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,生成+3价的铁离子,然后加入过量的NaOH溶液,E为NaAlO2溶液,可在溶液中通入二氧化碳气体,生成氢氧化铝沉淀,分解可生成氧化铝,沉淀F为Fe(OH)3,加热分解可生成氧化铁,以此解答该题.
解答 解:某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,先加过量铁2Fe3++Fe═3 Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,发生Fe+Cu2+═Cu+2Fe2+,由于铁过量,所以所得固体A包括Fe和Cu,G为稀盐酸或稀硫酸,C为Cu,B为Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,生成+3价的铁离子,然后加入过量的NaOH溶液,E为NaAlO2溶液,可在溶液中通入二氧化碳气体,生成氢氧化铝沉淀,分解可生成氧化铝,沉淀F为Fe(OH)3,加热分解可生成氧化铁,
(1)回收铁红、Al2O3和金属Cu,先加过量铁粉,2Fe3++Fe═3 Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,Cu2++Fe=Fe2++Cu,过滤得到Fe、Cu,
故答案为:Fe、Cu;
(2)金属铁可以和铁离子、铜离子之间反应,过滤所得溶液B中含有Al3+、Fe2+,酸过量,还含有氢离子,故答案为:Fe2+、Al3+;
(3)金属铁可以和盐酸、稀硫酸之间反应,但是金属铜和稀盐酸、稀硫酸之间不反应,据此实现金属铁和铜的分离,所以试剂G是稀盐酸或是稀硫酸,
故答案为:稀盐酸或稀硫酸;
(4)过滤所得溶液B中含有Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(5)分离Al3+、Fe2+,需加强碱,氢氧化铝既可以和强酸反应还可以和强碱反应,溶液E焰色反应呈黄色说明含有钠离子,说明试剂H是氢氧化钠,
故答案为:NaOH溶液.
点评 本题以铁、铝及其化合物为载体考查了物质间的转化及物质的推断,明确铝及其化合物的性质是解本题关键,根据铝、铁的性质及工业上冶炼、铁铝的原料为突破口采用正逆结合的方法推断,将铝、铁及其化合物的知识总结归纳而形成知识网络,灵活运用,注意:氢氧化铝能溶于强碱但不溶于弱碱.

 阅读快车系列答案
阅读快车系列答案| A. | 用淀粉溶液检验溶液中是否存在碘离子 | |
| B. | 用分液漏斗分离水与乙醇的混合物 | |
| C. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 用排饱和食盐水集气法收集氯气 |
| t/s | 0 | 5 | 15 | 25 | 35 |
| N(M)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 35s时,N的浓度为0.80mol•L-1 | |
| B. | 达到平衡时,M的转化率为80% | |
| C. | 相同温度下若起始时向容器中充入1.0molP,则达到平衡时P的浓度为0.1mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20molM、0.20molN和1.0molP,反应达到平衡前v(逆)<v(正) |

| A. | 电子流向:B电极→用电器→A电极→电解质→B电极 | |
| B. | A电极上发生的一个电极反应为:2Li++S8+2e-═Li2S8 | |
| C. | 若用该电池在铁器上镀锌,电路中转移2 moI电子时,电镀池两电极质量差为65 g | |
| D. | 若用该电池电解精炼铜,负极减少7g时阳极减少质量为32 g |
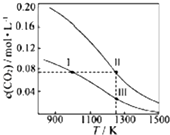 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
| A. | NaOH | B. | NH3 | C. | CH3COONa | D. | NH4Cl |
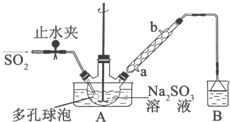 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: .
.