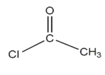
题目内容
【题目】浓硫酸在有化学实验中频繁出现,下列实验中浓硫酸的作用:
a.实验室制备乙酸乙酯:________;
b.实验室制乙烯:________。
【答案】催化剂、吸水剂 催化剂,脱水剂
【解析】
实验室用乙醇与乙酸、在浓硫酸并加热的条件下发生反应制取乙酸乙酯,用乙醇在浓硫酸、170℃的条件下制得乙烯。
a.实验室制备乙酸乙酯时,乙酸与乙醇发生酯化反应,反应的化学方程式为CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,在反应中,浓硫酸的作用:催化剂、吸水剂;
CH3COOC2H5+H2O,在反应中,浓硫酸的作用:催化剂、吸水剂;
b.实验室制乙烯时,乙醇在浓硫酸作用下发生消去反应,反应的化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O,浓硫酸的作用:催化剂,脱水剂。
CH2=CH2↑+H2O,浓硫酸的作用:催化剂,脱水剂。
答案为:催化剂、吸水剂;催化剂,脱水剂。

 阅读快车系列答案
阅读快车系列答案【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C.H两种元素组成;②球棍模型为 |
C | ①由C.H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的酯 |
D | ①由C.H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的化学方程式为:___;反应类型___。
(2)B具有的性质是___(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(3)C所含官能团的名称是___,D所含官能团的名称是___,C和D发生酯化的反应方程式___。
【题目】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性己检验)。
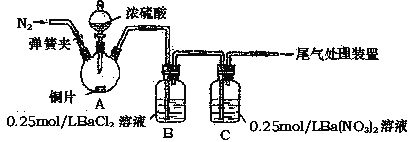
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | -------------------------------------------------- |
从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是__________________________________________。
(2)C中白色沉淀是_________,该沉淀的生成表明SO2具有_________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为是白雾参与反应。
①为证实各自的观点,在原实验基础上,甲同学在原有操作之前增加一步操作,该操作是_____________;乙同学在A、B间增加洗气瓶D,D中盛放的试剂是____________。
②甲、乙两同学分别改进实验后,B装置中现象分别为:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。请用离子方程式解释甲、乙两同学改进实验后仍然产生沉淀的原因,甲:___________________,乙:__________________。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是______________________。
【题目】在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H22NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3.有恒温恒压下欲保持平衡时各组分的体积分数不变.填表(恒温恒压)
已知 编号 | 起始状态物质的量/mol | 平衡时NH3的 物质的量/mol | ||
N2 | H2 | NH3 | ||
1 | 4 | 0 | a | |
① | 1.5 | 9 | 0 | ________ |
② | ________ | ________ | 1 | 0.5a |
③ | m | g(g=4m) | 0 | ________ |