题目内容
4.下列哪个说法可以证明反应N2+3H2?2NH3已达到平衡状态( )| A. | 1个N≡N键断裂的同时,有1个H-H键形成 | |
| B. | 1个N≡N键断裂的同时,有3个H-H键断裂 | |
| C. | 1个N≡N键断裂的同时,有6个N-H键断裂 | |
| D. | 1个N≡N键断裂的同时,有6个H-H键形成 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、1个N≡N键断裂的同时,有1个H-H键形成,变化量之比不等于计量数之比,故A错误;
B、1个N≡N键断裂的同时,有3个H-H键断裂,都体现正反应方向,故B错误;
C、1个N≡N键断裂等效于6个N-H键形成的同时有6个N-H键断裂,故C正确;
D、1个N≡N键断裂的同时,应有3个H-H键形成,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
3.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收a kJ的能量,下列说法正确的是( )
①石墨不如金刚石稳定
②金刚石不如石墨稳定
③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
④石墨转化为金刚石是氧化还原反应.
①石墨不如金刚石稳定
②金刚石不如石墨稳定
③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
④石墨转化为金刚石是氧化还原反应.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
12.下列物质中含有非极性共价键的离子化合物是( )
| A. | Cl2 | B. | Na2O2 | C. | H2O2 | D. | MgCl2 |
19.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=-296.8 kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO;△H=116.2 kJ/mol(反应热) |
9.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.
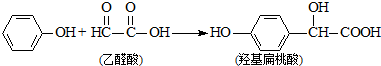
下列有关说法正确的是( )
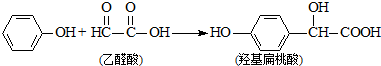
下列有关说法正确的是( )
| A. | 该反应是加成反应 | B. | 苯酚和羟基扁桃酸是同系物 | ||
| C. | 该反应是取代反应 | D. | 乙醛酸不能与 NaOH溶液反应 |
16.将如图所示实验装置的 K 闭合,下列判断正确的是( )
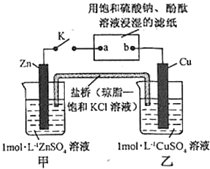

| A. | Cu 电极上发生还原反应 | B. | 电子沿 Zn→a→b→Cu 路径流动 | ||
| C. | 片刻后甲池中 c(SO42-)增大 | D. | 片刻后可观察到滤纸 b 点变红色 |
13.用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒后驾车.反应的方程式为:2CrO3+3CH3CH2OH+3H2SO4═Cr2(SO4)3+3CH3CHO+6H2O,此反应的氧化剂是( )
| A. | H2SO4 | B. | CrO3 | C. | Cr2(SO4)3 | D. | CH3CH2OH |
14.铅蓄电池反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列说法中正确的是( )
| A. | 放电时,蓄电池内电路中H+向负极移动 | |
| B. | 放电时,每通过lmol电子,蓄电池就要消耗2molH2SO4 | |
| C. | 充电时,阳极反应:PbSO4+2e-→Pb+SO42- | |
| D. | 充电时,铅蓄电池的负极与外接电源的负极相连 |
 .
.