题目内容
12.一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物填空和回答下列问题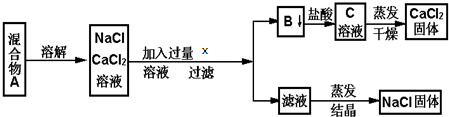
(1)X物质是Na2CO3(写化学式)
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有毛病,这一步的正确设计方案应是加入适量盐酸至不产生气体.
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是A.
分析 分离NaCl和CaCl2两种固体混合物,溶解后加入过量碳酸钠溶液,生成碳酸钙沉淀和氯化钠,碳酸钙和盐酸发生:CaCO3+2H+=Ca2++CO2↑+H2O,得到氯化钙溶液,经蒸发可得到氯化钙固体;
由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,加入稀盐酸最合适,碳酸钠和稀盐酸生成氯化钠和水和二氧化碳,蒸发后最后的固体物质是氯化钠.
解答 解:(1)分离NaCl和CaCl2两种固体混合物,溶解后加入过量碳酸钠溶液,生成碳酸钙沉淀和氯化钠,故答案为:Na2CO3;
(2)由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,向滤液中加入适量盐酸至不产生气体,生成氯化钠和水和二氧化碳,蒸发后最后的固体物质是氯化钠,故答案为:加入适量盐酸至不产生气体;
(3)要测定该样品中NaCl和CaCl2的质量比,可称量干燥的碳酸钙的质量,根据反应CaCO3+2H+=Ca2++CO2↑+H2O可计算氯化钙的质量,混合物A的总质量减去氯化钙的质量可得氯化钠的质量,故答案为:A.
点评 本题考查物质的分离、提纯知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作方法,为解答该题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中( )
| A. | 氧化产物与还原产物的粒子个数比为5:2 | |
| B. | 氧化产物与还原产物的粒子个数比为2:5 | |
| C. | 氧化剂与还原剂的粒子个数之比为1:8 | |
| D. | 氧化剂与还原剂的粒子个数之比为1:5 |
20.下列物质属于电解质的是( )
| A. | CO2 | B. | Al | C. | 食盐水 | D. | BaSO4 |
7.下列说法中,正确的是( )
| A. | 石油是混合物 | |
| B. | 油脂是天然高分子化合物 | |
| C. | 铜的活动性比铁弱,可在海轮外壳装铜块减缓海轮腐蚀 | |
| D. | 氨气显碱性,可用浓硫酸干燥 |
4.用NA表示阿伏加德罗常数的值,下列有关说法不正确的是( )
| A. | 标准状况下,22.4LN2与CO混合气体的质量为28g | |
| B. | 常温常压下,金属与酸反应生成2g H2,转移电子数为2NA | |
| C. | 含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子 | |
| D. | 1L1mol•L-1的氨水,含NA个NH3•H2O |
1.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有( )
| A. | 1种 | B. | 2种 | C. | 3 种 | D. | 4种 |