题目内容
3.粗盐中常含有泥沙等不溶性杂质及溶于水的钙、镁、硫酸根等离子.试设计出提纯少量粗盐的实验方案.并写出主要方程式.分析 加入NaOH溶液可除去镁离子,加BaCl2溶液可除去硫酸根离子,加Na2CO3溶液可是除去钙离子和过量的钡离子,由此可知,Na2CO3溶液的加入一定在BaCl2溶液之后,为了不使产生的沉淀溶解,一定要在过滤后再加盐酸,以此解答该题.
解答 解:粗盐的提纯中,为了保证杂质离子完全出去,每一次所加试剂都过量,加入NaOH溶液的目的是除去镁离子,加BaCl2溶液的目的是除去硫酸根离子,加Na2CO3溶液的目的是除去钙离子和过量的钡离子,由此可知,Na2CO3溶液的加入一定在BaCl2溶液之后,为了不使产生的沉淀溶解,一定要在过滤后再加盐酸,则方案为:
①加过量BaCl2溶液,发生Ba2++SO42-═BaSO4↓;
②加过量的NaOH,发生Mg2++2OH-=Mg(OH)2↓;
③加过量Na2CO3溶液,发生Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓;
④过滤;
⑤加适量盐酸,发生OH-+H+=H2O,CO32-+2H+=H2O+CO2↑,
答:①加过量BaCl2溶液,发生Ba2++SO42-═BaSO4↓;
②加过量的NaOH,发生Mg2++2OH-=Mg(OH)2↓;
③加过量Na2CO3溶液,发生Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓;
④过滤;
⑤加适量盐酸,发生OH-+H+=H2O,CO32-+2H+=H2O+CO2↑.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的原理,理解实验的步骤,难度不大.

练习册系列答案
相关题目
13.欧盟国家将从今年起禁用水银温度计,因为它在使用中易破碎,泄漏水银而危害人体健康,水银属于( )
| A. | 化合物 | B. | 混合物 | C. | 单质 | D. | 氧化物 |
11.在室温下取pH=a的NH3•H2O、NaOH溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,下列说法不正确的是( )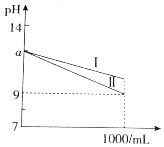

| A. | 曲线Ⅰ表示NaOH溶液中pH的变化 | |
| B. | 开始时两溶液中水的电离程度相同 | |
| C. | 由图象可知,开始时c(NaOH)=0.01mol•L-1 | |
| D. | 在稀释过程中氨水溶液中的$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
18.对于在一个密闭容器中进行的反应C(s)+H2O(g)?CO(g)+H2(g),下列条件的改变对反应速率几乎没有影响的是( )
①增加C的量 ②增加CO的量 ③将容器的体积缩小一半
④保持体积不变,充N2以增大压强 ⑤增加反应体系的温度
⑥保持压强不变,充入N2以增大体积.
①增加C的量 ②增加CO的量 ③将容器的体积缩小一半
④保持体积不变,充N2以增大压强 ⑤增加反应体系的温度
⑥保持压强不变,充入N2以增大体积.
| A. | ③⑤ | B. | ②④ | C. | ③④ | D. | ①④ |
8.下列关于NA的说法正确的是( )
| A. | 标准状况下,11.2LHF所含的分子数为0.5NA | |
| B. | 常温下,100mL2mol/L的明矾溶液净水时,生成具有净水作用的微粒数为0.2NA | |
| C. | 常温下,1L0.1mol/LNH4NO3溶液中氧原子数为0.3NA | |
| D. | 标准状况下,4.2gCH2=CH2和CH3CH=CH2的混合气体中所含有的氢原子数为0.6NA |
15.化学在生产和日常生活中有着重要的应用.下列说法正确的是( )
| A. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 | |
| B. | 氢氟酸保存在细口玻璃瓶中 | |
| C. | 高纯度的硅单质广泛用于制作光导纤维 | |
| D. | 大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 |
12.下列有关说法错误的是( )
| A. | 硅可用于制造光导纤维 | |
| B. | 铝槽车可用于浓硫酸的贮运 | |
| C. | 铝热反应可用于焊接铁轨 | |
| D. | 呈液态钠钾合金可用于快中子反应堆的热交换剂 |
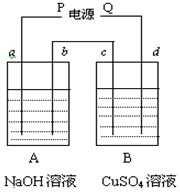 按如图装置实验,a、b、c、d均为惰性电极,A、B两烧杯中分别盛放NaOH溶液和足量CuSO4溶液.通电一段时间后,c电极质量增加6.4g,试回答:
按如图装置实验,a、b、c、d均为惰性电极,A、B两烧杯中分别盛放NaOH溶液和足量CuSO4溶液.通电一段时间后,c电极质量增加6.4g,试回答: