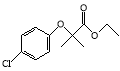
题目内容
【题目】用下列几个实验,可快速制取实验室所需的少量气体,并进行相关性质实验。(实验装置如图所示)

(1)若B中是生石灰,C中盛有AlCl3溶液,将A中液体逐滴加入B内,实验中观察到C溶液中出现白色沉淀。则A中液体的是_______(填名称),C中发生反应的离子方程式为_________________________。
(2)若要制O2,B为黑色固体,A中的试剂是_________(填化学式),C中盛有FeCl2和KSCN的混合液,旋开分液漏斗的开关后,发现C中溶液变为血红色,同时生成红褐色沉淀。写出C中发生氧化还原反应的离子方程式_______。
(3)已知氧化性强弱:KMnO4>Cl2>KIO3>I2。若A中装有浓盐酸,B中装有固体KMnO4,C中盛有KI淀粉溶液,C中的现象是_____________,继续反应一段时间后,发现C中溶液的颜色褪去,这是因为______________________。
【答案】 浓氨水 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ H2O2 12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓ 溶液变蓝 在溶液中碘单质被过量氯气氧化,所以蓝色褪去
【解析】(1)可溶性铝盐遇碱生成氢氧化铝沉淀;
(2)根据H2O2溶液在MnO2作催化剂的条件下分解制氧气,氧气能氧化Fe2+生成Fe3+,Fe3+遇KSCN的溶液变红;
(3)根据浓盐酸能被KMnO4氧化生成氯气,氯气能氧化I-生成I2,氯气过量,碘单质被过量的氯气氧化生成IO3-。
(1)可溶性铝盐遇碱生成氢氧化铝沉淀,加入浓氨水,与生石灰反应放出氨气,氨气通入氯化铝溶液中生成氢氧化铝白色沉淀,反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(2)因H2O2溶液在MnO2作催化剂的条件下分解产生氧气,有气泡逸出,氧气具有氧化性,能氧化Fe2+生成Fe3+,离子方程式为12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓,Fe3+遇KSCN的溶液变红色;
(3)浓盐酸能被KMnO4氧化生成氯气:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,氯气能氧化I-:Cl2+2KI=I2+2KCl,I2遇淀粉变蓝色;过量的氯气能继续氧化碘单质生成IO3-,所以继续反应一段时间后,蓝色褪去。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案