题目内容
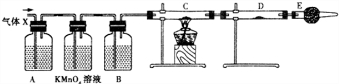
15.标准状况下,在三个干燥烧瓶一瓶为干燥纯净氨气,一瓶含一半空气的氯化氢和一瓶为二氧化氮和氧气的混合气(体积比:V(NO2):V(O2)=4:1),然后分别做喷泉实验,则三瓶中所得溶液的物质的量浓度之比为( )| A. | 2:1:2 | B. | 5:5:4 | C. | 1:1:1 | D. | 无法确定 |
分析 先根据n=$\frac{V}{{V}_{m}}$计算各气体的物质的量之比,然后计算烧瓶中溶液的体积、溶质的物质的量,最后根据物质的量浓度公式c=$\frac{n}{V}$判断三瓶中所得溶液的物质的量浓度之比.
解答 解:在相同条件下,气体摩尔体积相同,烧瓶的容积相同,根据n=$\frac{V}{{V}_{m}}$知,氨气、氯化氢、NO2、O2的物质的量之比为5:2.5:4:1,
做喷泉实验时,盛放氨气的烧瓶、含一半空气的氯化氢气体的烧瓶、含NO2和O2的混合气体(体积比为4:1)的烧瓶,各烧瓶中溶液的体积分别为:一烧瓶、半烧瓶、一烧瓶,所以溶液的体积比为2:1:2,
因为4NO2+O2+2H2O=4HNO3硝酸的物质的量和和二氧化氮的物质的量相等,
所以各烧瓶中溶质的物质的量之比为5:2.5:4,
根据c=$\frac{n}{V}$知,各物质的量浓度之比为:$\frac{5}{5}$:$\frac{2.5}{2.5}$:$\frac{4}{5}$=5:5:4,
故选B.
点评 本题考查的是物质的量浓度的有关计算,题目难度中等,正确求算盛放氯化氢气体的烧瓶溶液的体积、盛放NO2和O2气体的烧瓶溶质的物质的量是解本题的关键.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
6.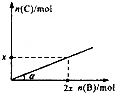 某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )
某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )
 某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )
某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )| A. | 若保持压强不变,降低温度时,图中角度a将变小 | |
| B. | 若增大压强,缩小容器的体积,平衡向正反应方向移动 | |
| C. | 若保持压强不变,再通入B,则再次达到平衡时正、逆反应速率均增大 | |
| D. | 平衡时B、C的物质的量之比为1:2 |
3.分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 燃烧必须有氧气参与,因而没有氧气参与的反应一定没有燃烧现象 | |
| C. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 | |
| D. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间 |
20.Cu和浓H2SO4反应得到25g CuSO4•5H2O,被还原的H2SO4是( )
| A. | 9.8g | B. | 15.3g | C. | 19.6g | D. | 30.6g |
7.下列有关物质的量及其单位的说法正确的是( )
| A. | 物质的量就是指物质的多少 | |
| B. | 物质的量和摩尔是两个不同的物理量 | |
| C. | 物质的量为1mol的物质含有约6.02×1023个粒子 | |
| D. | 1mol SO2和1mol SO3的质量相同 |
4.以硫酸铝溶液为原料之一,在实验室里制取少量Al(OH)3,并且易于分离,最好向溶液中加入( )
| A. | 氢氧化钠溶液 | B. | 氢氧化钡溶液 | C. | 氨水溶液 | D. | 澄清的石灰水 |