题目内容
13.下列做法不能起防锈作用的是( )| A. | 保留铁制品上的铁锈 | B. | 在铁制品表面镀锌 | ||
| C. | 在金属机械上涂油 | D. | 在盆、缸子的表面刷搪瓷 |
分析 铁在有水和氧气存在的情况下易生锈,防止生锈的措施有:采取涂油、涂漆或刷搪瓷等形式隔绝空气或水;牺牲阳极的阴极保护法;外加电源的阴极保护法等.
解答 解:A、铁锈不是致密的结构,对内层的铁起不到保护作用,故A正确;
B、在铁制品表面镀锌后,即使锌层破损,则锌做负极,铁制品做正极被保护,也会起到防锈的作用,故B错误;
C、在金属机械上涂油,会起到隔绝空气和水的作用,能起到防锈的作用,故C错误;
D、在盆或缸的表面刷搪瓷,能起到隔绝空气和水的作用,能起到防锈的作用,故D错误;
故选A.
点评 本题主要考查了防锈的方法和知识,应注意根据金属生锈的条件来分析.

练习册系列答案
相关题目
16.如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.则以下说法不正确的是 ( )

| A. | 电源B极是负极 | |
| B. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 | |
| C. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | 装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 |
4.某化学兴趣小组用图所示装置制备干燥纯净的氯气,并探究氯气的性质.请回答下列问题:
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为小于0.5mol(选填“大于”、“小于”、“等于”).
(2)兴趣小组的同学准备在F中装入FeCl2溶液以验证Cl2的氧化性,则该反应的化学方程式2FeCl2+3Cl2=2FeCl3.
(3)兴趣小组同学一致认为氯气能使湿润的红色布条褪色,但对于使湿润的红色布条褪色的原因看法不一致,为探究原因,特设计下列实验.(已知:Cl2+H2O?HCl+HClO)
(4)兴趣小组的某同学认为整套实验装置还存在一处明显缺陷,该缺陷是缺乏尾气处理装置.

(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为小于0.5mol(选填“大于”、“小于”、“等于”).
(2)兴趣小组的同学准备在F中装入FeCl2溶液以验证Cl2的氧化性,则该反应的化学方程式2FeCl2+3Cl2=2FeCl3.
(3)兴趣小组同学一致认为氯气能使湿润的红色布条褪色,但对于使湿润的红色布条褪色的原因看法不一致,为探究原因,特设计下列实验.(已知:Cl2+H2O?HCl+HClO)
| 提出假设 | 验证假设 | 得出结论 |
| ①能使红色布条褪色是HCl ②能使红色布条褪色是HClO ③能使红色布条褪色是Cl2(写化学式) | 实验①:把红色布条伸入稀盐酸中,红色布条不褪色. 实验②:E、F分别装入A(填标号),干燥的红色布条不褪色,湿润的红色布条褪色. A.干燥的红色布条、湿润的红色布条 B.湿润的红色布条、干燥的红色布条 | 氯水中的HClO (写化学式)能使湿润的红色布条褪色. |

1.用酒精加热下列各物质,有单质生成的是( )
| A. | 浓HNO3 | B. | NaHCO3 | C. | NH4Cl | D. | Fe(OH)3 |
8.试管中盛有少量白色固体,确认其是铵盐的方法是( )
| A. | 加水,将湿润的红色石蕊试纸放在试管口 | |
| B. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| C. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
18.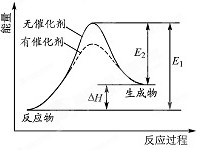 某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
 某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能降低反应的活化能 | |
| C. | 催化剂能改变反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
2.制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ、向粗盐水中加入过量BaCl2溶液,操作X;
Ⅱ、向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ、滤液用盐酸调节pH,获得第一次精制盐水.
(1)操作X使用的主要仪器为:漏斗、烧杯、玻璃棒.
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全.
②过程Ⅱ之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,检验Ba2+的操作是取少量清液放置于试管中,先加入盐酸,再加入硫酸钠溶液,若无白色沉淀,则可证明溶液无Ba2+.
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去NH4+的离子方程式是3ClO-+2NH4+=3Cl-+N2↑+2H++3H2O.
②实验室从水溶液分离出I2的操作名称为萃取.
③过程Ⅵ中,产品NaOH在电解槽的阴极区生成(填“阳极”或“阴极”),该电解槽为阳离子交换膜电解槽(填“阳”或“阴”).
Ⅰ、向粗盐水中加入过量BaCl2溶液,操作X;
Ⅱ、向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ、滤液用盐酸调节pH,获得第一次精制盐水.
(1)操作X使用的主要仪器为:漏斗、烧杯、玻璃棒.
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②过程Ⅱ之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,检验Ba2+的操作是取少量清液放置于试管中,先加入盐酸,再加入硫酸钠溶液,若无白色沉淀,则可证明溶液无Ba2+.
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去NH4+的离子方程式是3ClO-+2NH4+=3Cl-+N2↑+2H++3H2O.
②实验室从水溶液分离出I2的操作名称为萃取.
③过程Ⅵ中,产品NaOH在电解槽的阴极区生成(填“阳极”或“阴极”),该电解槽为阳离子交换膜电解槽(填“阳”或“阴”).
3.与乙烷作为同系物的是( )
| A. | C4H8 | B. | C2H4 | C. | C8H20 | D. | C12H26 |