题目内容
已知:在25时H2O![]() H++OH- KW=10-14
H++OH- KW=10-14
HAC![]() H++A
H++A![]() Ka=1.8×10-5
Ka=1.8×10-5
(1)醋酸钠水解的平衡常数Kh的表达式为 。当升高温度时,Kh将 (填“增大”“减小”“不变”);
(2)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(3)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为 0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14、
![]() =2.2)
=2.2)
(1)Kh=![]() (2分);增大(2分) (2)小于(1分);大于(1分)
(2分);增大(2分) (2)小于(1分);大于(1分)
(3)Cd2+、Zn2+(2分);
[OH-]=2.2×10-5mol·L-1
[M2+][OH-]2=5×10-12(mol·L-1)3
5×10-12小于KSP[Mg(OH)2]=1.8×10-11
5×10-12大于KSP[Zn(OH)2]=1.2×10-17
5×10-12大于KSP[Cd(OH)2]=2.5×10-14(3分)
解析:略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
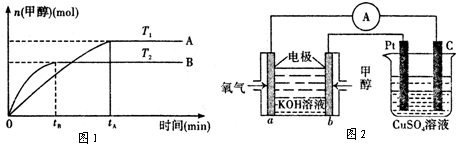
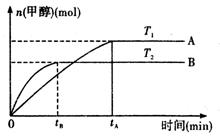
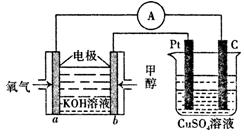
 CH3OH(g)+H2O (g ).在其它条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
CH3OH(g)+H2O (g ).在其它条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)