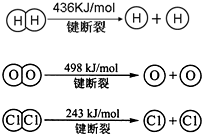
题目内容
能源问题是人类社会面临的重大课题.甲醇是未来重要的绿色能源之一.
(l)已知:在 25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ.请写出甲醇燃烧的热化学方程式 .
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+3H2(g)
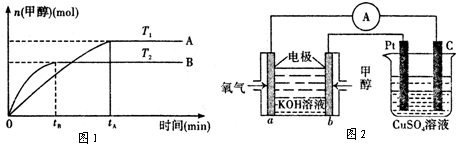
CH3OH(g)+H2O(g)在其它条件不变的情况下,实验测得温度对反应的影响如图1所示(注:T1、T2均大于300℃):
①合成甲醇反应的△H 0.(填“>”、“<”或“=”).
②平衡常数的表达式为: .温度为T2时的平衡常数 温度为T1时的平衡常数(填“>”、“<”或“=”)
③在T1温度下,将1mol CO2和 1molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强的比值为 .
(3)利用甲醇燃料电池设计如图2所示的装置.该装置中 Pt 极为 极;写出b极的电极反应式 .

(l)已知:在 25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ.请写出甲醇燃烧的热化学方程式
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+3H2(g)
| 催化剂 | 加热 |
①合成甲醇反应的△H
②平衡常数的表达式为:
③在T1温度下,将1mol CO2和 1molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强的比值为
(3)利用甲醇燃料电池设计如图2所示的装置.该装置中 Pt 极为
分析:(1)依据题干条件,1g甲醇燃烧生成二氧化碳和液态水放热22.70KJ,所以32g甲醇燃烧生成二氧化碳和液态水放热726.40KJ,依据热化学方程式的书写方法写出;
(2)①图象分析先拐先平,温度高T2先达到平衡则T2>T1,纵轴是甲醇的物质的量,温度越高,甲醇越少,依据平衡移动原理分析判断;
②依据化学方程式和平衡常数概念写出平衡常数表达式,图象分析先拐先平,温度高T2先达到平衡则T2>T1,纵轴是甲醇的物质的量,温度越高,甲醇越少,平衡逆向进行分析判断;
③根据平衡三段式列式计算,相同条件下,气体压强之比等于物质的量之比;
(3)甲醇燃料电池,燃料在负极发生氧化反应,与负极连接的是阴极,与正极连接的为阳极,电池负极反应是甲醇失电子,在碱性溶液中生成碳酸盐,依据电荷守恒写出电极反应.
(2)①图象分析先拐先平,温度高T2先达到平衡则T2>T1,纵轴是甲醇的物质的量,温度越高,甲醇越少,依据平衡移动原理分析判断;
②依据化学方程式和平衡常数概念写出平衡常数表达式,图象分析先拐先平,温度高T2先达到平衡则T2>T1,纵轴是甲醇的物质的量,温度越高,甲醇越少,平衡逆向进行分析判断;
③根据平衡三段式列式计算,相同条件下,气体压强之比等于物质的量之比;
(3)甲醇燃料电池,燃料在负极发生氧化反应,与负极连接的是阴极,与正极连接的为阳极,电池负极反应是甲醇失电子,在碱性溶液中生成碳酸盐,依据电荷守恒写出电极反应.
解答:解:(1)已知:在 25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ,32g甲醇燃烧生成二氧化碳和液态水放热726.40KJ,甲醇燃烧的热化学方程式为CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.40KJ/mol,
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.40KJ/mol;
(2)①根据题给图象分析可知,T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2?CH3OH+H2O向逆反应方向移动,故正反应为放热反应,△H<0,
故答案为:<;
②依据化学方程式和平衡常数概念写出平衡常数表达式,K=
;T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2?CH3OH+H2O向逆反应方向移动,则T1时的平衡常数比T2时的大,
故答案为:
;<;
③在T1温度下,将1mol CO2和 1molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)
起始量(mol) 1 1 0 0
变化量(mol) α 3α α α
平衡量(mol)1-α 1-3α α α
则容器内的压强与起始压强的比值等于物质的量之比=(2-2α):2=1-α,
故答案为:1-α;
(3)甲醇燃料电池中甲醇在b电极发生氧化反应,为负极反应,氧气在a电极发生还原反应,为正极反应,与负极相连的Pt电极为阴极,碳电极为阳极,b电极发生的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:阴;CH3OH-6e-+8OH-=CO32-+6H2O.
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)①根据题给图象分析可知,T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2?CH3OH+H2O向逆反应方向移动,故正反应为放热反应,△H<0,
故答案为:<;
②依据化学方程式和平衡常数概念写出平衡常数表达式,K=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
故答案为:
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
③在T1温度下,将1mol CO2和 1molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则
CO2(g)+3H2(g)
| 催化剂 |
| 加热 |
起始量(mol) 1 1 0 0
变化量(mol) α 3α α α
平衡量(mol)1-α 1-3α α α
则容器内的压强与起始压强的比值等于物质的量之比=(2-2α):2=1-α,
故答案为:1-α;
(3)甲醇燃料电池中甲醇在b电极发生氧化反应,为负极反应,氧气在a电极发生还原反应,为正极反应,与负极相连的Pt电极为阴极,碳电极为阳极,b电极发生的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:阴;CH3OH-6e-+8OH-=CO32-+6H2O.
点评:本题考查了热化学方程式书写,原电池原理和电解池原理的分析应用,化学平衡的计算方法,平衡常数概念理解计算,题目难度中等.

练习册系列答案
相关题目

 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g) Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义.