题目内容
【题目】某天然黄铜矿主要成分为![]() (含
(含![]() ),为测定该黄铜矿的纯度,某同学设计了如下实验:
),为测定该黄铜矿的纯度,某同学设计了如下实验:
称取硏细的黄铜矿样品![]() 煅烧,生成
煅烧,生成![]() 、
、![]() 、
、![]() 和
和![]() 气体,实验后取
气体,实验后取![]() 中溶液的1/10置于锥形瓶中,用
中溶液的1/10置于锥形瓶中,用![]() 标准碘溶液进行滴定,初读数为
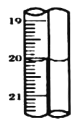
标准碘溶液进行滴定,初读数为![]() ,末读数如图所示,完成下列填空:
,末读数如图所示,完成下列填空:
(1)实验中称量样品所需定量仪器为____________。
(2)装置![]() 的作用是____________。
的作用是____________。
(3)上述反应结束后,仍需通一段时间的空气,其目的是____________。
(4)滴定时,标准碘溶液所耗体积为______![]() 。用化学方程式表示滴定的原理:____________。
。用化学方程式表示滴定的原理:____________。
(5)计算该黄铜矿的纯度____________。
(6)工业上利用黄铜矿冶炼铜产生的炉渣(含![]() ,
,![]() ,
,![]() ,
,![]() )可制备
)可制备![]() 。选用提供的试剂:稀盐酸、稀硫酸、
。选用提供的试剂:稀盐酸、稀硫酸、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,设计实验验证炉渣中含有
溶液,设计实验验证炉渣中含有![]() 。所选试剂为____________,证明炉渣中含有
。所选试剂为____________,证明炉渣中含有![]() 的实验方案为____________。
的实验方案为____________。
【答案】电子天平 除去混合气体中未反应的氧气,防止干扰二氧化硫的检验 将系统装置中![]() 全部排入
全部排入![]() 中充分吸收 20.00
中充分吸收 20.00 ![]()
![]() 稀硫酸、
稀硫酸、![]() 溶液 取样于试管中,用稀硫酸浸取炉渣,取上层清液滴加少量
溶液 取样于试管中,用稀硫酸浸取炉渣,取上层清液滴加少量![]() 溶液,若褪色,则含有
溶液,若褪色,则含有![]()
【解析】
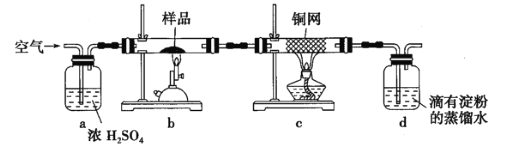
从实验装置图看,a为去除空气中水蒸气的装置,b为黄铜矿石的煅烧装置,c为未反应O2的处理装置,d为SO2的吸收装置。
(1)称取的黄铜矿样品质量为0.230g,有三位小数,是托盘天平不能完成的,所以实验中称量样品所需定量仪器为电子天平。
(2)装置c的作用是除去混合气体中未反应的氧气,防止干扰二氧化硫的检验。
(3)若上述反应结束后,立即停止通空气,则装置及导管内都会滞留SO2,给实验造成误差。故反应结束后,仍需通一段时间的空气,其目的是将系统装置中![]() 全部排入
全部排入![]() 中充分吸收。
中充分吸收。
(4)根据装置图可判断滴定时,标准碘溶液所耗体积为20.00![]() 。用化学方程式表示滴定的原理:
。用化学方程式表示滴定的原理:![]() 。
。
(5)n(SO2)=n(I2)=0.01mol/L×0.02000L×10=0.002mol
n(![]() )=n(SO2)/2=0.001mol,w(
)=n(SO2)/2=0.001mol,w(![]() )%=
)%=![]() ;
;
(6)加酸溶解后,溶液中含有Fe2+、Fe3+,不能使用![]() 溶液,应使用
溶液,应使用![]() 溶液检验
溶液检验
Fe2+的存在。因为![]() 溶液能将Cl-氧化,所以加入的酸只能用硫酸,不能用盐酸。故所选试剂为稀硫酸、
溶液能将Cl-氧化,所以加入的酸只能用硫酸,不能用盐酸。故所选试剂为稀硫酸、![]() 溶液。证明炉渣中含有
溶液。证明炉渣中含有![]() 的实验方案为:取样于试管中,用稀硫酸浸取炉渣,取上层清液滴加少量
的实验方案为:取样于试管中,用稀硫酸浸取炉渣,取上层清液滴加少量![]() 溶液,若褪色,则含有
溶液,若褪色,则含有![]() 。
。