题目内容
(1)实验室用标准NaOH溶液来滴定盐酸,测定盐酸浓度,若用酚酞作指示剂,下列操作可能使测定结果偏低的是__________。
A.碱式滴定管中装碱液前未用标准液润洗2~3次
B.开始实验时,碱式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.盛盐酸的锥形瓶用盐酸润洗2~3次
D.锥形瓶内溶液的颜色由无色变为粉红色,立即记下滴定管内液面所在刻度
E.滴定前平视,滴定终点时仰视滴定管刻度

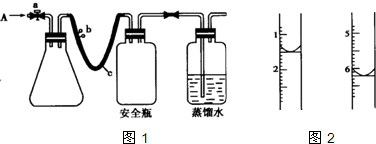
(2)如图为某浓度的NaOH溶液滴定10 mL一定浓度的盐酸的示意图:根据上述两图分析:①HCl溶液的浓度是______________,NaOH溶液的浓度是
________________________________________________________________________;
②x=________。
(3)现有四瓶溶液,分别是NaCl(0.1 mol/L)、HCl(0.1 mol/L)、NaOH(0.1 mol/L)和酚酞试液(0.1%),不用其他试剂把他们一一鉴别开来,实验步骤如下:
①各取溶液少许,两两混合,根据现象不同分成两组:Ⅰ组是HCl和________,Ⅱ组是NaOH和________。
②取Ⅱ组中C、D混合液,不断滴入Ⅰ组中A溶液,若无明显现象,则A是________,B是________。
③把已鉴别出的B溶液2 mL滴入3滴未知C溶液,再加入D溶液4 mL,在这整个过程中无明显变化,则C是________,D是________。
(1)D
(2)①0.1 mol· L-1 0.05 mol·L-1 ②0.001
(3)①NaCl 酚酞 ②NaCl HCl ③NaOH 酚酞
【解析】
试题分析:(1)由c待= ,其中r标、r待分别为标准酸或碱的元数、待测酸或碱的元数。决定c待大小的因素在于V标的误差,A中未用标准碱液润洗,使V标增大,c待偏高;B中由于气泡存在使V标增大;C中由于锥形瓶用待测液润洗,使V标增大;D中颜色变红,立即停止,由于混合不均匀,V标偏小;E中仰视终点刻度,使V标增大,故只有D符合。
,其中r标、r待分别为标准酸或碱的元数、待测酸或碱的元数。决定c待大小的因素在于V标的误差,A中未用标准碱液润洗,使V标增大,c待偏高;B中由于气泡存在使V标增大;C中由于锥形瓶用待测液润洗,使V标增大;D中颜色变红,立即停止,由于混合不均匀,V标偏小;E中仰视终点刻度,使V标增大,故只有D符合。
(2)由图中,未滴定时,pH=1,说明盐酸中H+浓度为0.1 mol/L,即盐酸浓度为0.1 mol/L,而加入20 mL NaOH溶液可以中和10 mL 0.1 mol/L盐酸,说明NaOH溶液浓度为0.05 mol/L,n(NaOH)=0.05 mol/L×0.02 L=0.001 mol。
(3)相互两两混合后,酚酞遇NaOH变红为Ⅱ组,Ⅰ组为NaCl和HCl。Ⅱ组中混合液若加入Ⅰ组中HCl,则红色消失,而加入Ⅰ组中的A无现象,说明A是NaCl,则B是HCl。如果B(HCl)加入C(若为酚酞)无现象,再加入D(为NaOH)则出现红色,如无变化,则C为NaOH,D为酚酞试液。
考点:考查酸碱中和滴定的有关判断和计算,物质的鉴别和检验
点评:该题是中等难度的试题,试题综合性强,在注重对学生基础知识巩固和训练的同时侧重对学生实验设计和动手操作能力的培养,有利于培养学生的逻辑推理能力和创新思维能力。