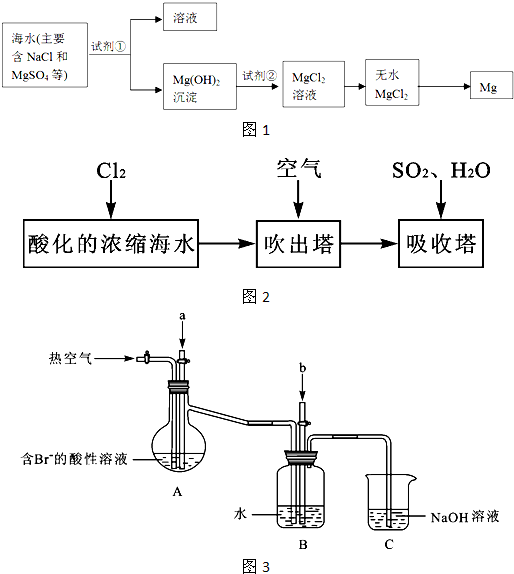
题目内容
海水资源的利用具有广阔前景.海水中主要离子的含量如下:
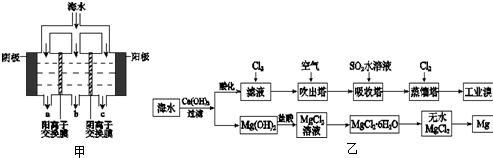
(1)电渗析法淡化海水示意图如图甲所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.
①阳极主要电极反应式是
②在阴极附近产生少量白色沉淀,其成分有
③淡水的出口为
(2)利用海水可以提取溴和镁,提取过程如图乙所示:
①提取溴的过程中,经过2次Br-→Br2转化的目的是
②从MgCl2溶液中得到MgCl2?6H2O晶体的主要操作是
③依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42 | 2560 | Br- | 64 |
| Mg2+ | 1272 |

(1)电渗析法淡化海水示意图如图甲所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.
①阳极主要电极反应式是
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.②在阴极附近产生少量白色沉淀,其成分有
Mg(OH)2
Mg(OH)2
和CaCO3,生成CaCO3的离子方程式是Ca2++OH-+HCO3-=CaCO3↓+H2O
Ca2++OH-+HCO3-=CaCO3↓+H2O
.③淡水的出口为
b
b
(填“a”、“b”或“c”).(2)利用海水可以提取溴和镁,提取过程如图乙所示:
①提取溴的过程中,经过2次Br-→Br2转化的目的是
对溴元素进行富集
对溴元素进行富集
,吸收塔中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-
SO2+Br2+2H2O=4H++2Br-+SO42-
.解释通空气的目的是通入空气将Br2蒸气带出,使Br2(g)?Br2(aq)或Br2+H2O?HBr+HBrO平衡向左移动
通入空气将Br2蒸气带出,使Br2(g)?Br2(aq)或Br2+H2O?HBr+HBrO平衡向左移动
.②从MgCl2溶液中得到MgCl2?6H2O晶体的主要操作是
加热浓缩、冷却结晶
加热浓缩、冷却结晶
、过滤、洗涤、干燥.③依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
179.2
179.2
L(忽略Cl2溶解).分析:(1)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气;阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(2)提取溴的过程中,经过2次Br-→Br2转化的目的是更多的得到溴单质;吸收塔内通入的是二氧化硫气体是和溴单质反应生成溴离子,在蒸馏塔中被氯气氧化得到更多的溴单质;通空气的目的是溴单质被空气带出;氯化镁溶液中得到氯化镁晶体的 操作是加热蒸发冷却结晶;依据离子方程式计算得到需要的氯气体积.
(2)提取溴的过程中,经过2次Br-→Br2转化的目的是更多的得到溴单质;吸收塔内通入的是二氧化硫气体是和溴单质反应生成溴离子,在蒸馏塔中被氯气氧化得到更多的溴单质;通空气的目的是溴单质被空气带出;氯化镁溶液中得到氯化镁晶体的 操作是加热蒸发冷却结晶;依据离子方程式计算得到需要的氯气体积.
解答:解:(1)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气;阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出,
①阳极主要电极反应式是海水选的阴离子失电子发生氧化反应,氯离子放电能力大于氢氧根离子,所以电极反应为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
②在阴极附近产生少量白色沉淀,阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Mg(OH)2;Ca2++OH-+HCO3-=CaCO3↓+H2O;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,通过用一段时间海水中的 阴阳离子在两个电极放电,所以水在b处流出,故答案为:b;
(2)①依据利用海水可以提取溴和镁,流程中提取溴的过程中,经过2次Br-→Br2转化的目的是更多的得到溴单质,提取过程对溴元素进行富集;吸收塔内通入的是二氧化硫气体是和溴单质反应生成溴离子,在蒸馏塔中被氯气氧化得到更多的溴单质,吸收塔中反应的离子方程式为;SO2+Br2+2H2O=4H++2Br-+SO42-;通空气的目的是通入空气将Br2蒸气带出,使Br2(g)?Br2(aq)或Br2+H2O?HBr+HBrO平衡向左移动,
故答案为:提取过程对溴元素进行富集;SO2+Br2+2H2O=4H++2Br-+SO42-;通入空气将Br2蒸气带出,使Br2(g)?Br2(aq)或Br2+H2O?HBr+HBrO平衡向左移动;
②从MgCl2溶液中得到MgCl2?6H2O晶体的主要操作是:加热浓缩、冷却结晶,故答案为:加热浓缩、冷却结晶;
③若将10m3海水中的溴元素转化为工业溴,依据图表中溴元素含量为64mg/L,10m3海水中含溴元素=10×1000L×64g/L×10-3=640g;物质的量=
=8mol,依据反应计算得到:2Br-+Cl2=Br2+2Cl-,消耗氯气物质的量为:0.4mol;提取过程中需要两次通入氯气实现溴离子被氧化,所以至少需要标准状况下Cl2的物质的量为8 mol标准状况下体积为 8mol×22.4L/mol=179.2L,
故答案为:179.2
①阳极主要电极反应式是海水选的阴离子失电子发生氧化反应,氯离子放电能力大于氢氧根离子,所以电极反应为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
②在阴极附近产生少量白色沉淀,阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Mg(OH)2;Ca2++OH-+HCO3-=CaCO3↓+H2O;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,通过用一段时间海水中的 阴阳离子在两个电极放电,所以水在b处流出,故答案为:b;
(2)①依据利用海水可以提取溴和镁,流程中提取溴的过程中,经过2次Br-→Br2转化的目的是更多的得到溴单质,提取过程对溴元素进行富集;吸收塔内通入的是二氧化硫气体是和溴单质反应生成溴离子,在蒸馏塔中被氯气氧化得到更多的溴单质,吸收塔中反应的离子方程式为;SO2+Br2+2H2O=4H++2Br-+SO42-;通空气的目的是通入空气将Br2蒸气带出,使Br2(g)?Br2(aq)或Br2+H2O?HBr+HBrO平衡向左移动,
故答案为:提取过程对溴元素进行富集;SO2+Br2+2H2O=4H++2Br-+SO42-;通入空气将Br2蒸气带出,使Br2(g)?Br2(aq)或Br2+H2O?HBr+HBrO平衡向左移动;
②从MgCl2溶液中得到MgCl2?6H2O晶体的主要操作是:加热浓缩、冷却结晶,故答案为:加热浓缩、冷却结晶;
③若将10m3海水中的溴元素转化为工业溴,依据图表中溴元素含量为64mg/L,10m3海水中含溴元素=10×1000L×64g/L×10-3=640g;物质的量=
| 640g |
| 80g/mol |
故答案为:179.2
点评:本题考查了海水淡化的电渗析原理的分析判断,海水中溴的提取过程,溶液中得到固体的条件应用,反应过程中的氧化剂计算,注意氯气两次氧化消耗,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目