题目内容
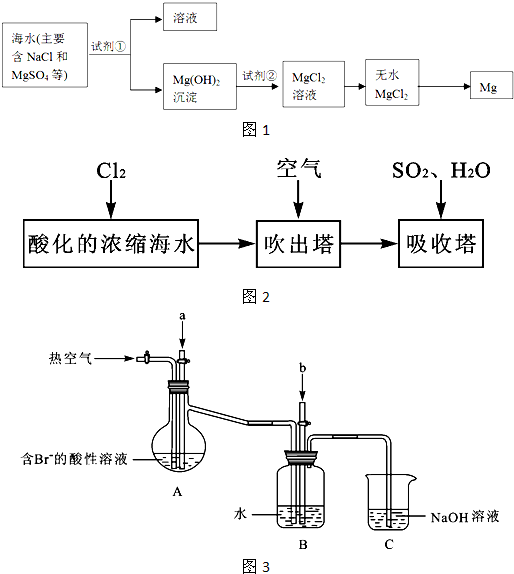
海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下:

①为了使MgSO4转化为Mg(OH)2,试剂①可以选用
②试剂②可以选用
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是
A.Mg(OH)2
MgO
Mg
B.Mg(OH)2
MgO
Mg
C.Mg(OH)2
MgCl2
Mg
D.Mg(OH)2
MgCl2
Mg
④写出电解制备镁的化学方程式

①为了使MgSO4转化为Mg(OH)2,试剂①可以选用
NaOH
NaOH
,②试剂②可以选用
盐酸
盐酸
;③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是
C
C
.A.Mg(OH)2
| △ |
| ||
| 2800℃ |
B.Mg(OH)2
| △ |
| ||
| 还原 |
C.Mg(OH)2
| HCl |
| ||
| 714℃ |
D.Mg(OH)2
| HCl |
| ||
| 还原 |
④写出电解制备镁的化学方程式
MgCl2(熔融)
Mg+Cl2↑
| ||
MgCl2(熔融)
Mg+Cl2↑
.
| ||
分析:①利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂;
②利用复分解反应及Mg(OH)2转化为MgCl2时阴离子的变化来选择试剂;
③MgO的熔点高,制备镁一般利用电解熔融的MgCl2;
④制备镁一般利用电解熔融的MgCl2;
②利用复分解反应及Mg(OH)2转化为MgCl2时阴离子的变化来选择试剂;
③MgO的熔点高,制备镁一般利用电解熔融的MgCl2;
④制备镁一般利用电解熔融的MgCl2;
解答:解:①使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择NaOH,故答案为:NaOH;
②Mg(OH)2转化为MgCl2时,酸能溶解沉淀,由阴离子可知,试剂②可以选用盐酸,故答案为:盐酸;
③MgO的熔点高,不能利用电解或还原法来制备镁,则ABD错误;适宜的冶镁方法是C,故答案为:C;
④制备镁一般利用电解熔融的MgCl2,电解反应为MgCl2(熔融)
Mg+Cl2↑,
故答案为:MgCl2(熔融)
Mg+Cl2↑.
②Mg(OH)2转化为MgCl2时,酸能溶解沉淀,由阴离子可知,试剂②可以选用盐酸,故答案为:盐酸;
③MgO的熔点高,不能利用电解或还原法来制备镁,则ABD错误;适宜的冶镁方法是C,故答案为:C;
④制备镁一般利用电解熔融的MgCl2,电解反应为MgCl2(熔融)
| ||
故答案为:MgCl2(熔融)
| ||
点评:本题考查镁的制备,明确海水中镁的制备的流程及试剂的选择来分析解答,注意MgO的熔点高是学生解答中易忽略的地方,制备镁利用电解法.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法错误的是( )


| A、可用BaCl2溶液除去粗盐中的SO42- | B、从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2═2Cl-+Br2 | C、试剂1可以选用石灰乳 | D、工业上,电解熔融MgO冶炼金属镁 |



 (2012?海淀区一模)海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法不正确的是( )
(2012?海淀区一模)海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法不正确的是( )