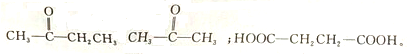题目内容
可用来判断金属性强弱的依据是( )
| A、原子电子层数的多少 |
| B、最外层电子数的多少 |
| C、最高价氧化物的水化物的碱性强弱 |
| D、等物质的量的金属置换氢气的多少 |
考点:金属在元素周期表中的位置及其性质递变的规律,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:利用金属元素的单质与水或酸反应置换出氢气的难易程度、最高价氧化物的水化物的碱性、金属活动性顺序、金属元素在周期表中的递变规律等比较金属性,以此来解答.
解答:
解:A.金属性与电子层多少无直接关系,同族金属元素可由电子层数比较金属性,故A错误;
B.金属单质在反应中失去电子的能力越强则失电子的能力越强,与最外层电子数的多少无关,故B错误;
C.金属元素的最高价氧化物对应的水化物的碱性越强,则失电子能力越强,金属性越强,故C正确;
D.金属性越强,则失电子能力越强,置换出氢气的反应越剧烈,与生成氢气多少无关,故D错误;
故选C.
B.金属单质在反应中失去电子的能力越强则失电子的能力越强,与最外层电子数的多少无关,故B错误;
C.金属元素的最高价氧化物对应的水化物的碱性越强,则失电子能力越强,金属性越强,故C正确;
D.金属性越强,则失电子能力越强,置换出氢气的反应越剧烈,与生成氢气多少无关,故D错误;
故选C.
点评:本题考查金属性的比较,为高频考点,把握金属性比较的方法和角度为解答的关键,注意规律性知识的归纳及应用,选项D为易错点,题目难度不大.

练习册系列答案
相关题目
将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为a mol?L-1的HC1溶液,滴加过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加盐酸溶液体积为V2L.将溶液在HCl气流下蒸干充分灼烧得到固体W2g.下列关系式中正确的是( )
| A、35.5a=(w2-w1 )V2 | ||
B、n(Al)>
| ||
C、n(Na)+3n(Al)=
| ||
D、aV2=
|
下列说法不正确的是( )
| A、有些金属晶体比原子晶体熔沸点高 |
| B、晶体只要有阴离子就一定有阳离子 |
| C、原子晶体中一定有非极性共价键 |
| D、分子晶体中不一定有共价键 |
下列属于同分异构体的是( )
| A、CH4和CH3CH3 |
| B、CH3-CH2-Cl和CH2Cl-CH2Cl |
| C、CH2=CHCH2CH3和CH3CH=CHCH3 |
D、 和 和 |
下列反应达到平衡时,哪种条件下生成物的含量最高:X2(g)+2Y2(g)?X2Y4(g)△H<0( )
| A、高温 高压 |
| B、低温 低压 |
| C、高温 低压 |
| D、高压 低温 |
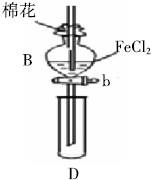 某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下: 则
则 发生羟醛缩合反应的产物不可能是( )
发生羟醛缩合反应的产物不可能是( )