题目内容
18. 体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液,分别加水稀释至体积V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液,分别加水稀释至体积V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | XOH是弱碱 | |
| B. | pH=10的两种溶液中的c(X+ ):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32- )减小 |
分析 A.根据图知,0.1mol/L的XOH的pH=13,说明XOH溶液中c(OH-)=c(XOH);
B.XOH是强碱溶液、X2CO3是强碱弱酸盐溶液,要使两种溶液的pH相等,则c(XOH)<c(X2CO3),再结合物料守恒判断;
C.0.10mol/LX2CO3溶液的pH=11.6,则该溶液中c(OH-)=c(HCO3-)=$\frac{1{0}^{-14}}{1{0}^{-11.6}}$mol/L=10-2.4 mol/L,c(CO32-)=0.1mol/L,Kh1=$\frac{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{K}_{w}}{{K}_{a2}}$,则Ka2=$\frac{{K}_{w}}{{K}_{h1}}$=$\frac{Kwc(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}$;
D.当lgV=2时,则溶液的体积变为原来的100倍,升高温度,促进水解,第一步水解程度远远大于第二步,所以溶液中c(CO32-)减小,c(HCO3-)增大.
解答 解:A.根据图知,0.1mol/L的XOH的pH=13,说明XOH溶液中c(OH-)=c(XOH),XOH完全电离,为强电解质,故A错误;
B.XOH是强碱溶液、X2CO3是强碱弱酸盐溶液,要使两种溶液的pH相等,则c(XOH)<c(X2CO3),再结合物料守恒得c(X+):XOH小于X2CO3,故B错误;
C.0.10mol/LX2CO3溶液的pH=11.6,则该溶液中c(OH-)=c(HCO3-)=$\frac{1{0}^{-14}}{1{0}^{-11.6}}$mol/L=10-2.4 mol/L,c(CO32-)=0.1mol/L,Kh1=$\frac{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{K}_{w}}{{K}_{a2}}$,则Ka2=$\frac{{K}_{w}}{{K}_{h1}}$=$\frac{Kwc(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}$=$\frac{1{0}^{-14}×0.1}{1{0}^{-2.4}×1{0}^{-2.4}}$=1.0×10-10.2≈1.0×10-10,故C正确;
D.当lgV=2时,则溶液的体积变为原来的100倍,升高温度,促进水解,第一步水解程度远远大于第二步,所以溶液中c(CO32-)减小,c(HCO3-)增大,所以c(HCO3-)/c(CO32- )增大,故D错误;
故选C.
点评 本题考查弱电解质在水溶液中电离平衡、pH的计算,侧重考查学生分析判断及计算能力,为高频考点,明确电离平衡常数与水解平衡常数的关系是解本题关键,注意:二元弱酸中存在Kh1.Ka2=Kw,为易错点.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案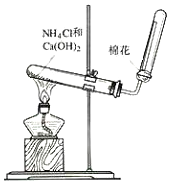
| A. | 收集方法是向下排空气法 | |
| B. | 将湿润的蓝色石蕊试纸放在试管口处验满 | |
| C. | 试管口的棉花可防止氨气与空气形成对流,利于收集氨气 | |
| D. | 实验结束后将蘸有稀硫酸的棉花放在导管口吸收剩余氨气 |
| A. | 60 mL 0.03 mol•L-1HCl溶液 | B. | 60 mL 0.04 mol•L-1KCl溶液 | ||
| C. | 20 mL 0.03 mol•L-1CaCl2溶液 | D. | 50 mL 0.05 mol•L-1AgNO3溶液 |
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)22 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3 SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
| A. | 显蓝色的淀粉溶液中通入足量的SO2后变成无色溶液:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OHˉ═CaCO3↓+H2O | |
| D. | 盛放烧碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O |
| A. | 棉织物滴浓硫酸变黑 | B. | 皮肤上沾了浓硝酸后变黄 | ||
| C. | 米饭咀嚼后有甜味 | D. | 鸡蛋白在热水中凝固 |