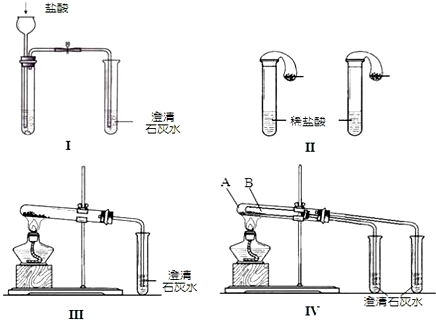
题目内容
9.已知:草酸晶体(H2C2O4•xH2O)于100℃开始失水,101.5℃熔化,约157℃时升华,于175℃受热分解.某校甲、乙两组学生用不同方式探究草酸的部分化学性质并测定其结晶水的含量.Ⅰ.甲组用滴定法测定草酸晶体中结晶水的含量.
步骤一:称取5.0g纯净的草酸晶体,配制成250mL溶液.
步骤二:取0.04mol•L-1标准酸性KMnO4溶液25.00mL于锥形瓶中,用所配溶液滴定至终点.
请回答下列问题:
①配制草酸溶液的操作步骤依次是:将晶体置于烧杯中,加水溶解,将溶液转移入250mL容量瓶,洗涤,定容,摇匀.
②完善下面滴定反应的离子方程式:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
③在“步骤一”和“步骤二”测定操作中需要重复进行的操作是步骤二 (填“步骤一”或“步骤二”).
④其它操作均正确的情况下,下列操作可能使测定结果偏大的是BC.
A.锥形瓶瓶壁残留蒸馏水就转移入酸性KMnO4溶液进行滴定
B.酸式滴定管用蒸馏水洗后未用待测溶液润洗就加入待测液进行滴定
C.滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失
D.滴定完成后俯视刻度
Ⅱ.乙组同学为探究草酸的性质,按如图所示装置进行实验(夹持装置未标出):
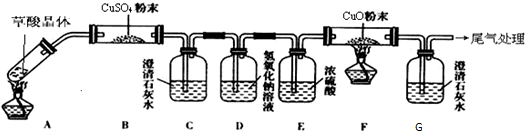
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末部分变红.据此回答:
①草酸分解的化学方程式为H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+H2O.
②乙组同学将B装置称量,却发现B装置质量增量比理论值大,该小组同学认真分析断定操作无误,则其原因可能是在加热时草酸部分升华在B中部分凝华.
③乙组中某同学认为可以利用加热分解的草酸晶体的质量和F装置中固体质量的减少就可以计算出晶体中结晶水的含量,立即遭到其他同学的反对,其反对的理由是前面的反应装置中滞留有大量CO气体;为防止爆炸在点燃F处酒精灯之前要先通一段时间的CO以排除装置系统中的空气;装置G中的水蒸气逆流进入装置F中;加热时草酸部分升华未能全部分解.
分析 Ⅰ.①草酸溶解后转移到250ml的容量瓶定容,得到所配置的溶液;
②分析反应前后元素化合价变化可知,Mn元素化合价从+7价变化为+2价,化合价降低做氧化剂,草酸中的碳元素化合价应升高,从+3价升高为+4价,所以以后产物为二氧化碳,依据电子守恒配平的离子方程式;
③步骤一是称量配制只需要一次准确操作,步骤二是滴定过程,为避免产生较大误差,滴定实验一般需要重复2-3次,所以测定操作中需要重复进行的操作是步骤二;
④依据滴定实验误差分析的依据是c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析判断;
Ⅱ.①依据实验装置过程中的反应现象分析草酸分解得到产物,结合原子守恒写出化学方程式;
②发现B装置质量增量比理论值大,该小组同学认真分析断定操作无误,依据草酸损耗的因素分析判断;
③依据利用加热分解的草酸晶体的质量和F装置中固体质量的减少就可以计算出晶体中结晶水的含量,实验设计分析,过程中产生误差的因素是生成的一氧化碳不能全部反应,试验时需要在整套装置中充满一氧化碳避免点燃时发生爆炸,草酸可能为全部分解,装置G中 液体倒流会装置F导致称量质量产生误差;
解答 解:Ⅰ.①草酸溶解后转移到250ml的容量瓶定容,配制得到所需的溶液,故答案为:250mL容量瓶;
②分析反应前后元素化合价变化可知,Mn元素化合价从+7价变化为+2价,化合价降低做氧化剂,草酸中的碳元素化合价应升高,从+3价升高为+4价,所以以后产物为二氧化碳,依据电子守恒配平的离子方程式为:2MnO4-+5H2C2O4+6H+=Mn2++10CO2↑+8H2O;
故答案为:2、5、6、2、10CO2↑、8;
③步骤一是称量配制只需要一次准确操作,步骤二是滴定过程,为避免产生较大误差,滴定实验一般需要重复2-3次,所以测定操作中需要重复进行的操作是步骤二;
故答案为:步骤二;
④A.锥形瓶瓶壁残留蒸馏水就转移入酸性KMnO4溶液进行滴定,对实验无影响,故A不符合;
B.酸式滴定管用蒸馏水洗后未用待测溶液润洗就加入待测液进行滴定,结构消耗标准液体积增大,结构偏高,故B符合;
C.滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失,滴定终点后读取标准液体积增大,测定浓度偏大,故C符合;
D.滴定完成后俯视刻度,读取的标准液体积减小,结构偏低,故D不符合;
故答案为:BC;
Ⅱ.①B中CuSO4粉末变蓝,说明分解产物含有水蒸气,装置C、G中澄清石灰水变浑浊,F中CuO粉末部分变红,证明生成的产物中含有二氧化碳气体和一氧化碳气体,依据原子守恒配平写出的化学方程式为:H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+H2O;
故答案为:H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+H2O;
②发现B装置质量增量比理论值大,该小组同学认真分析断定操作无误,说明草酸在加热分解过程中变成蒸气的在装置B的玻璃管内壁凝结
故答案为:在加热时草酸部分升华在B中部分凝华;
③依据利用加热分解的草酸晶体的质量和F装置中固体质量的减少就可以计算出晶体中结晶水的含量,实验设计分析,过程中产生误差的因素是生成的一氧化碳不能全部反应,试验时需要在整套装置中充满一氧化碳避免点燃时发生爆炸,草酸可能为全部分解,装置G中 液体倒流会装置F导致称量质量产生误差;
故答案为:前面的反应装置中滞留有大量CO气体;为防止爆炸在点燃F处酒精灯之前要先通一段时间的CO以排除装置系统中的空气;装置G中的水蒸气逆流进入装置F中;加热时草酸部分升华未能全部分解.
点评 本题考查了物质性质的探究实验设计和实验现象的理解应用,掌握实验基础是解题关键,题目较为综合,题目难度中等,做题时注意抓住反应的现象,以此推断物质可能具有的性质.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用激光笔照射鸡蛋白水溶液 | 有丁达尔效应 | 鸡蛋白分子直径介于1nm~100nm |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 碳酸盐X加热分解,产生的气体通入酸化的BaCl2溶液 | 产生白色沉淀 | X可能是NaHCO3 |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y一定是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
(1)查阅资料,获得下列信息:
①化合物A在工业上一般用铝土矿为原料,通过下列流程制备:

②化合物A是一种白色透明晶体,易溶于热水,水溶液呈酸性;
(2)实验探究:
| 实验 | 实验步骤 | 实验结果 |
| ① | 称取9.06g的结晶化合物A加热 | 加热到质量恒定时,质量减轻了4.32g; |
| ② | 将加热后所得的固体分成两等份,分别加适量的水,制成溶液. | |
| ③ | 在一份溶液中加入足量的BaCl2溶液. | 产生4.66g 白色沉淀; |
| ④ | 在另一份溶液中,逐滴加入2mol•L-1的NaOH溶液. | 先观察到产生白色沉淀,接着产生有刺激性气味的气体B,沉淀逐渐溶解,当加入25mL的氢氧化钠溶液时,沉淀恰好完全溶解. |
(1)请写出铝土矿与硫酸主要反应的离子方程式Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O.
(2)结晶水合物A的化学式为NH4Al(SO4)2•12H2O.
(3)A用作净水剂的原理是Al3++3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示).
(4)气体B可与空气构成燃料电池,生成稳定的单质和水,请写出以KOH为电解质,该燃料电池的负极电极反应式2NH3-6e-+6OH-=N2+6H2O.
| A. | 7:2 | B. | 2:7 | C. | 1:2 | D. | 2:1 |
| A. | CO2的结构式为:O-C-O | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_{6}^{14}$C | |
| C. | 氯化镁的电子式: | |
| D. | 用电子式表示氯化氢分子的形成过程: |