题目内容
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示.试根据元素在周期表中的位置,分析图中曲线的变化特点,并完成下列问题:
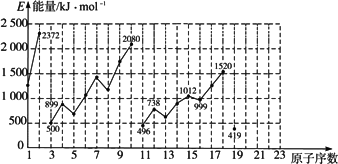
(1)同主族内不同元素的E值变化的特点是________,各主族中E值的这种变化特点体现了元素性质的________规律.
(2)同周期内随原子序数的增大,E值增大.但个别元素的E值出现反常现象,试预测下列关系中正确的是________(填写编号).
①E(砷)>E(硒)
②E(砷)<E(硒)
③E(溴)>E(硒)
④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:________<E<________.
(4)10号元素E值较大的原因是________.
答案:
解析:
解析:
|
答案:(1)随原子序数增大,E值变小 周期性 (2)①③ (3)419 738或填E(钾) E(镁) (4)10号元素是氖,该元素原子最外层电子排布已达8电子稳定结构 解析:本题图示列出了1至19号元素气态原子失去最外层一个电子所需的能量,考查的是识图能力. (1)由图可知,同主族元素随核电荷数的增大,原子失去最外层一个电子的能力逐渐增强,所需的能量逐渐减小,这与实验事实是一致的. (2)分析图象,同一周期元素原子失去一个电子所需能量呈增大趋势.但反常的是E(氮)>E(氧),E(磷)>E(硫).砷、硒、溴同属第四周期,分别处于ⅤA、ⅥA、ⅦA族,变化规律应类似于二、三周期. 即E(砷)>E(硒),由于ⅥA、ⅦA族元素的E值未出现反常现象,应为E(溴)>E(硒),所以填①③. (3)1 mol Ca原子失去最外层一个电子比同周期的钾要困难,比同主族的镁要容易,故其E值应在419至738之间. |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目



