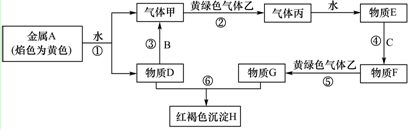
题目内容
1.0.2mol NH3含电子2 mol,含质子数为2NA.分析 根据1mol氨气中含10mol电子和分子呈中性,电子数等于质子数来分析;
解答 解:1mol氨气中含10mol电子和10mol的质子,所以0.2mol NH3含电子2mol电子和2mol的质子,所以质子数为2NA,故答案为:2;2NA.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.下列有关化学用语表示正确的是( )
| A. | CaH2的电子式为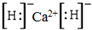 | |
| B. | Cl-的结构示意图: | |
| C. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| D. | 2,4,6-三硝基苯甲酸结构简式: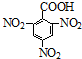 |
9.下列关于金属钠的叙述,错误的是( )
| A. | 钠的还原性很强,只能以化合态存在于自然界 | |
| B. | 钠质地柔软,可用小刀切割,保存在煤油中 | |
| C. | 钠失火后可用大量水或泡沫灭火器扑灭 | |
| D. | 钠的焰色反应为黄色,可用在雾天做指示灯 |
16.设NA表示阿伏加德罗常数.下列说法中,错误的是( )
| A. | 标准状况下,22.4 L氢气和氯气的混合气体,所含分子数为NA | |
| B. | 常温常压下,1 mol氦气含有的原子数约为NA | |
| C. | 1 mol Al3+含有核外电子数为3NA | |
| D. | t℃时,1 L pH=6的纯水中,含1×10-6NA个OH- |
6.对于相同物质的量的SO2和SO3,下列说法中正确的是( )
| A. | 硫元素的质量比为5:4 | B. | 分子数之比为1:1 | ||
| C. | 原子总数之比为2:3 | D. | 质量之比为1:1 |
13.下列实验操作顺序或方法正确的是( )
| A. | 把苯和浓溴水混合后加入FeBr3可制溴苯 | |
| B. | 浓硫酸与浓硝酸混合冷却后,边滴入苯边振荡,在60℃水浴中加热可制硝基苯 | |
| C. | 乙烷中混有乙烯,通入氢气与乙烯反应可达到除杂的目的 | |
| D. | 乙烯通入水中可制得酒精 |
10.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式:CH2-CH2-CH2 | B. | 丙烷分子的比例模型: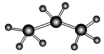 | ||
| C. | 四氯化碳分子的电子式: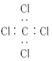 | D. | 1丁烯分子的键线式: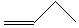 |