题目内容
11. 如图是元素周期表的一部分:
如图是元素周期表的一部分:| 数据编号 | 滴入NaOH溶液的体积/mL | 溶液的pH | |
| HX | HZ | ||
| 1 | 0 | 3 | 1 |
| 2 | 20.00 | a | b |
| A. | 通过分析可得表格中a<7,b=7 | |
| B. | 将上述的HZ溶液稀释100倍后pH比HX溶液的pH大 | |
| C. | 由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强 | |
| D. | 0.l000 mol•L-1 Na2Y的水溶液中:c(Y2-)+c(HY-)+c(H2Y)=0.1000 mol•L-1 |
分析 由元素在周期表中的位置可知X为F元素,Y为S元素,Z为Cl元素,由表中数据可知HX不能完全电离,为弱弱酸,HZ为强酸,加入等浓度的NaOH20.00mL时,生成的NaX溶液呈碱性,NaZ的盐溶液呈中性,结合物料守恒解答该题.
解答 解:A.HX为弱酸,HZ为强酸,加入等体积、等浓度的氢氧化钠溶液,a>7,b=7,故A错误;
B.HZ完全电离,而HX部分电离,等浓度的溶液稀释100倍后,HX的pH较大,故B错误;
C.F的非金属性比Cl强,但HF的酸性比HCl弱,Cl的非金属性比S强,但HCl的酸性比H2S弱,可知氢化物的酸性与非金属性不存在规律性的变化,故C错误;
D.0.l000 mol•L-1 Na2Y的水溶液中,由物料守恒可知c(Y2-)+c(HY-)+c(H2Y)=0.1000 mol•L-1,故D正确.
故选D.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,为高频考点,正确判断HX是弱电解质、HY是强弱电解质为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的综合应用能力,题目难度中等.

练习册系列答案
相关题目
1. 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )| A. | 该物质可以视为酚类 | |
| B. | 在浓硫酸作用下,分子内消去一个水分子,产物有三种同分异构体 | |
| C. | 能使溴的四氯化碳溶液褪色 | |
| D. | 该物质分子中的所有碳原子均共面 |
19.下列叙述正确的是( )
| A. | 乙烷中混有乙烯可用酸性高锰酸钾溶液来除去 | |
| B. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 已知2SO2(g)+O2(g)?2SO3(g)△H<0,该反应在任何温度下均可自发进行 | |
| D. | 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol•L-1 AgNO3溶液,先生成Ag2CrO4沉淀 |
6.某实验室欲制取少量单质硅,根据实验室存有的药品情况,选择硅铁粉(一种铁合金粉末)、漂白粉、浓盐酸等为制取原料.请回答以下制取过程中的相关问题.
(1)氯气的制备:用漂白粉与浓盐酸常温反应制备实验所需氯气.该反应的化学方程式为Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O.可选择以下装置如图1中的C(填序号)作为反应容器.

(2)SiCl4的生成:控制温度在200℃以上,使硅铁粉与氯气反应生成SiCl4.
①若要将图A装置改进为SiCl4的发生装置,需进行的改进是将单孔橡皮塞改为双孔塞;增加一根伸入试管底部附近的进气管.
②生成的SiCl4含有杂质CCl4,请说明杂质的来源硅铁合金粉中含有碳,与氯气反应生成了CCl4.
(3)SiCl4的收集:请结合下列图2、表回答问题:
①在E、F两套装置中选择一套来收集产物,你认为F(填编号)装置更好,理由是相对E,F可防粉末状反应物堵塞出口,可防液态产物堵塞气体通路.
②G或H装置用于连接在E或F装置后.若选用H作连接装置,则其中所装试剂应为碱石灰,其作用是吸收多余氯气防污染空气;防止空气中的水气进入收集装置使产物水解.
(4)提纯SiCl4:请提出一个你认为可行的除去杂质CCl4的方案蒸馏.
(5)纯硅的制取:用硅铁粉与盐酸制氢气还原SiCl4即可得到较纯的单质硅.该还原反应采用将反应混合物缓慢通过用酒精喷灯加热的石英玻璃管的方式进行,你认为可能观察到的实验现象是石英玻璃管壁上有灰黑色固体出现.
(1)氯气的制备:用漂白粉与浓盐酸常温反应制备实验所需氯气.该反应的化学方程式为Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O.可选择以下装置如图1中的C(填序号)作为反应容器.

(2)SiCl4的生成:控制温度在200℃以上,使硅铁粉与氯气反应生成SiCl4.
①若要将图A装置改进为SiCl4的发生装置,需进行的改进是将单孔橡皮塞改为双孔塞;增加一根伸入试管底部附近的进气管.
②生成的SiCl4含有杂质CCl4,请说明杂质的来源硅铁合金粉中含有碳,与氯气反应生成了CCl4.
(3)SiCl4的收集:请结合下列图2、表回答问题:
| 物质 | 熔点 | 沸点 | 水反应性 |
| SiCl4 | -70℃ | 57.6℃ | 强烈水解 |
| CCl4 | -22.9℃ | 76.8℃ | 稳定 |
②G或H装置用于连接在E或F装置后.若选用H作连接装置,则其中所装试剂应为碱石灰,其作用是吸收多余氯气防污染空气;防止空气中的水气进入收集装置使产物水解.
(4)提纯SiCl4:请提出一个你认为可行的除去杂质CCl4的方案蒸馏.
(5)纯硅的制取:用硅铁粉与盐酸制氢气还原SiCl4即可得到较纯的单质硅.该还原反应采用将反应混合物缓慢通过用酒精喷灯加热的石英玻璃管的方式进行,你认为可能观察到的实验现象是石英玻璃管壁上有灰黑色固体出现.
16.25℃时,下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
3. 锌银(Zn-Ag2O)电池多应用于军事、航空、移动的通信设备、电子仪器和人造卫星、宇宙航行等方面,用如图所示装置模拟其工作原理,下列说法正确的是( )
锌银(Zn-Ag2O)电池多应用于军事、航空、移动的通信设备、电子仪器和人造卫星、宇宙航行等方面,用如图所示装置模拟其工作原理,下列说法正确的是( )
 锌银(Zn-Ag2O)电池多应用于军事、航空、移动的通信设备、电子仪器和人造卫星、宇宙航行等方面,用如图所示装置模拟其工作原理,下列说法正确的是( )
锌银(Zn-Ag2O)电池多应用于军事、航空、移动的通信设备、电子仪器和人造卫星、宇宙航行等方面,用如图所示装置模拟其工作原理,下列说法正确的是( )| A. | K+向a极移动 | |
| B. | b 极的电极反应式为 Ag2O+H2O+2e-═2Ag+2OH- | |
| C. | 用该电池给铁棒镀铜,则铁棒与 b 极相连 | |
| D. | 电池工作一段时间后,电解液的pH减小 |
20.下列说法正确的是( )
| A. | 在实验室中,从海带中提取单质碘的方法:取样→灼烧→溶解→过滤→萃取 | |
| B. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色,水层变为棕黄色,说明Fe2+的还原性强于Br- | |
| D. | 室温下,向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,以除去苯中少量的苯酚 |
1.下列说法错误的是( )
| A. | 石油里含有C5~C12的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 重油裂化的目的主要是为了提高汽油的产量和质量 | |
| D. | 煤中含有苯和甲苯,可以通过分馏的方法将它们分离出来 |
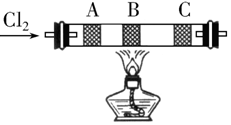 在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉(已知淀粉遇I2显蓝色)溶液的3个棉球(如图所示).由左端通入氯气,在B处加热,可观察到A处棉球呈橙色,B处棉球呈现黄色,C处棉球呈蓝色.将玻璃管冷却后,在B、C之间的玻璃壁上有紫黑色的固体(填物质状态),这是因为碘易升华.A、B两处发生的离子方程式分别是:Cl2+2Br-=Br2+2Cl-、Cl2+2I-=I2+2Cl-.
在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉(已知淀粉遇I2显蓝色)溶液的3个棉球(如图所示).由左端通入氯气,在B处加热,可观察到A处棉球呈橙色,B处棉球呈现黄色,C处棉球呈蓝色.将玻璃管冷却后,在B、C之间的玻璃壁上有紫黑色的固体(填物质状态),这是因为碘易升华.A、B两处发生的离子方程式分别是:Cl2+2Br-=Br2+2Cl-、Cl2+2I-=I2+2Cl-.