题目内容
硫元素可以形成多种物质如 、SO2、SO32-、SO42-等。
、SO2、SO32-、SO42-等。
(1) 中S原子的轨道杂化类型是 ,
中S原子的轨道杂化类型是 , 的空间构型是 。
的空间构型是 。
(2)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。分析表明该沉淀中Cu、S、N的物质的量之比为1:1:1,经测定该沉淀的晶体里有一种三角锥型的阴离子和一种正四面体型的阳离子。
①[Cu(NH3)4]SO4中Cu2+的电子排布式为 。
②[Cu(NH3)4]SO4中存在的化学键类型有 (填序号)。
| A.共价键 | B.氢键 | C.离子键 | D.配位键 E.分子间作用力 |
(1)sp3 三角锥型
(2)①[Ar]3d9 ②ACD (对一个给1分,全对给2分,只要有答案选错,该题得0分)
③SiCl4或SiF4 ④Cu(NH4)SO3
解析试题分析:(1)SCl3+中S原子的价电子对数为(6+3-1)/2=4,所以杂化类型为sp3,有3个配位原子,故空间构型是三角锥型;(2)②[Cu(NH3)4]SO4为配合物,[Cu(NH3)4]2+存在配位键,內界与外界形成离子键,NH3、SO42-存在共价键;③等电子体是原子数和最外层电子总数相同微粒,一般在同一周期左右元素和同族上下找,与SO42-互为等电子体的一种分子SiCl4或SiF4 或CCl4等;④三角锥型的阴离子和一种正四面体型的阳离子只能是SO32-、NH4+,结合沉淀中Cu、S、N的物质的量之比为1:1:1,化学式为Cu(NH4)SO3 。
考点:考查物质结构中杂化类型、空间结构、化学键类型、等电子体、核外电子排布等知识

下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是
| A.2Na2O2+2CO2=2Na2CO3+O2 | B.2Na+2H2O=2NaOH+H2↑ |
| C.Cl2+H2O?=?HCl+HclO | D.Na2CO3+BaCl2=BaCO3↓+2NaCl |
Ⅰ.(1)写出下列电子云的界面图表示的形成的键的类型:
①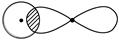
_________________________________________________________________。
②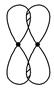
_________________________________________________________________。
③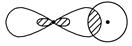
_________________________________________________________________。
④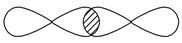
_________________________________________________________________。
(2)下列分子中,没有光学活性的是____________,含有两个手性碳原子的是
____________。
| A.乳酸CH3—CHOH—COOH |
| B.甘油CH2OH—CHOH—CH2OH |
| C.脱氧核糖CH2OH—CHOH—CHOH—CH2—CHO |
| D.核糖CH2OH—CHOH—CHOH—CHOH—CHO |
在乙烷(CH3—CH3)、乙烯(CH2=CH2)、乙炔(CH≡CH)分子中的碳碳键键长大小顺序为__________________________________。BCl3分子中Cl—B—Cl键角为__________,HgCl2分子中的键角为____________。
(3)金属键可以看成是由许多原子共用许多电子形成的,所以有人将金属键视为一种特殊形式的共价键。金属键与共价键的明显区别是①________________、②________________。
水是生命之源,与人类的生活密切相关。在化学实验和科学研究中,水有多种用途。
(1)下列说法中正确的是 (填序号)。
| A.每一个水分子内含有两个氢键 |
| B.水分子间存在范德华力,所以水分子稳定 |
| C.分子间形成的氢键使水的熔点和沸点升高 |
| D.冰熔化时水分子内共价键发生断裂 |
(3)水分子在特定条件下易形成水合氢离子(H3O+)。其中含有的化学键为 。
(4)如果需要增大水的电离程度,除了升高温度外,还可以采用的方法有 (回答一种即可)。若室温时,将某一元酸HA加水配成0.1 mol·L-1的稀溶液,此时HA在水中有0.1%发生电离,则由HA电离出的c(H+)约为水电离出的c(H+)的 倍。
(5)将一定量的Na2SO3固体溶于水,所得溶液中的电荷守恒关系式为 。
(6)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差异进行发电。已知该电池用金属银做负极,正极反应为5MnO2 +2Na++2e-
 Na2Mn5O10,请写出电池总反应式 。
Na2Mn5O10,请写出电池总反应式 。 下列有关金属的说法正确的是
| A.金属原子的核外电子在金属晶体中都是自由电子 |
| B.已知金属钠的晶体堆积模型是体心立方堆积,则其配位数是6 |
| C.已知金属镁的晶体堆积模型是六方最密堆积,则其配位数是12 |
| D.金属导电的实质是金属阳离子在外电场作用下的定向移动 |
下列有关晶体的说法中正确的是
| A.氯化钾溶于水时离子键未被破坏 |
| B.原子晶体中共价键越强,熔点越高 |
| C.冰融化时分子中共价键发生断裂 |
| D.范德华力越大,分子越稳定 |
电子表、电子计算器、电脑显示器都运用了液晶材料显示图像和文字。有关其显示原理的叙述中,正确的是 ( )。
| A.施加电场时,液晶分子沿垂直于电场方向排列 |
| B.移去电场后,液晶分子恢复到原来状态 |
| C.施加电场后,液晶分子恢复到原来状态 |
| D.移去电场后,液晶分子沿电场方向排列 |