题目内容
过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3?bH2O2.现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况).反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A.现向三份体积为10mL、浓度为c mol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如表所示:
(1)稀硫酸的物质的量浓度c= mol/L.
(2)计算确定过碳酸钠的化学式.
(3)工业上常以所含活性氧的质量分数[w(活性氧)=
×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品.现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00mL,试计算判断该样品是否为优等品.(已知:2Na2S2O3+I2═Na2S4O6+2NaI)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 5.0 | 10.0 | 15.0 |
| 生成气体的体积/mL(标准状况) | 44.8 | 89.6 | 112 |
(2)计算确定过碳酸钠的化学式.
(3)工业上常以所含活性氧的质量分数[w(活性氧)=
| 16n(H2O2) |
| m(样品) |
考点:探究物质的组成或测量物质的含量,有关有机物分子式确定的计算
专题:实验探究和数据处理题,计算题
分析:(1)加入MnO2粉末,充分反应后,经过过滤、洗涤后的溶液为碳酸钠溶液,由表中数据可知,硫酸体积不变,随碳酸钠溶液体积增大,生成二氧化碳气体的体积增大,Ⅰ、Ⅱ碳酸钠不足,由Ⅰ可知,生成二氧化碳44.8mL,消耗碳酸钠溶液的体积为5mL,Ⅱ、Ⅲ之间消耗5L碳酸钠溶液生成气体为112mL-89.6mL=22.4mL<44.8mL,故Ⅲ中硫酸完全反应,碳酸钠有剩余,应根据Ⅲ计算硫酸的浓度,根据n=
计算二氧化碳的物质的量,根据方程式计算消耗硫酸的物质的量,再根据c=
计算硫酸的物质的量浓度;
(2)根据n=
计算氧气的体积,结合方程式计算H2O2的物质的量,根据Ⅰ中二氧化碳体积计算5mL溶液中碳酸钠的物质的量,进而计算100mL溶液中碳酸钠的物质的量,据此确定过碳酸钠的化学式;
(3)据题意可得:n(H2O2)=n(Na2S2O3)×
=0.1mol/L×0.033L×
=1.65×10-3mol,依据活性氧的质量分数[w(活性氧)=
×100%]计算过碳酸钠的活性氧的质量分数.
| V |
| Vm |
| n |
| V |
(2)根据n=
| V |
| Vm |
(3)据题意可得:n(H2O2)=n(Na2S2O3)×
| 1 |
| 2 |
| 1 |
| 2 |
| 16n(H2O2) |
| m(样品) |
解答:
解:(1)加入MnO2粉末,充分反应后,经过过滤、洗涤后的溶液为碳酸钠溶液,由表中数据可知,硫酸体积不变,随碳酸钠溶液体积增大,生成二氧化碳气体的体积增大,Ⅰ、Ⅱ碳酸钠不足,由Ⅰ可知,生成二氧化碳44.8mL,消耗碳酸钠溶液的体积为5mL,Ⅱ、Ⅲ之间消耗5L碳酸钠溶液生成气体为112mL-89.6mL=22.4mL<44.8mL,故Ⅲ中硫酸完全反应,碳酸钠有剩余,应根据Ⅲ计算硫酸的浓度,则:n(CO2)=
=0.005mol,由Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,可知n(H2SO4)=n(CO2)=0.005mol,故c(H2SO4)=
=0.5mol/L,
故答案为:0.5;
(2)n(O2)=
=0.03mol
n(H2O2)=0.06mol
由实验Ⅰ中数据可知,5mLA溶液中:
n(Na2CO3)=n(CO2)=
=2×10-3mol
所以100mLA中含有20×2×10-3=0.04mol
n(Na2CO3):n(H2O2)=0.04:0.06=2:3
所以化学式为2Na2CO3?3H2O2;
答:碳酸钠的化学式为:2Na2CO3?3H2O2;
(3)据题意可得:n(H2O2)=n(Na2S2O3)×
=0.1mol/L×0.033L×
=1.65×10-3mol,
该过碳酸钠的活性氧的质量分数为:
×100%=13.2%>13%;
所以该过碳酸钠样品为优等品;
答:该样品是为优等品.
| 0.112L |
| 22.4L/mol |
| 0.005mol |
| 0.01L |
故答案为:0.5;
(2)n(O2)=
| 0.672L |
| 22.4L/mol |
n(H2O2)=0.06mol
由实验Ⅰ中数据可知,5mLA溶液中:
n(Na2CO3)=n(CO2)=
| 0.0448L |
| 22.4L/mol |
所以100mLA中含有20×2×10-3=0.04mol
n(Na2CO3):n(H2O2)=0.04:0.06=2:3
所以化学式为2Na2CO3?3H2O2;
答:碳酸钠的化学式为:2Na2CO3?3H2O2;
(3)据题意可得:n(H2O2)=n(Na2S2O3)×
| 1 |
| 2 |
| 1 |
| 2 |
该过碳酸钠的活性氧的质量分数为:
| ||
| 0.2 |
所以该过碳酸钠样品为优等品;
答:该样品是为优等品.
点评:本题考查混合物的有关计算,根据数据判断反应过量问题是关键,侧重考查学生对实验数据的分析处理能力,注意产生二氧化碳的反应是碳酸钠与硫酸反应,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
根据元素周期表和元素周期律分析下面的推断,其中正确的是( )
| A、锂、钠、钾的原子半径逐渐增大 |
| B、钠比镁活泼 |
| C、溴单质的氧化性比氯气强 |
| D、氢氧化钠比氢氧化钾的碱性强 |
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸的体积之间的关系如图所示,下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸的体积之间的关系如图所示,下列判断正确的是( )| A、通入CO2后,不能确定A烧杯中的溶质 |
| B、B烧杯中通入的CO2体积为448mL |
| C、原NaOH溶液的浓度为0.2mol/L |
| D、通入CO2后,C烧杯中溶质成分为NaOH和Na2CO3,且物质的量相等 |
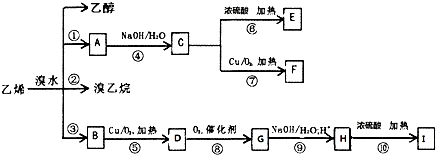
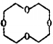 I的分子式为C4H4O4,是一种环状化合物.请回答下列问题:
I的分子式为C4H4O4,是一种环状化合物.请回答下列问题:
 b.CH3CH2CH2CH2CH3 c.CH3CH=CHCH3 d.CH3CH=CH2
b.CH3CH2CH2CH2CH3 c.CH3CH=CHCH3 d.CH3CH=CH2



