题目内容
在25℃下,向氨水中滴加蒸馏水,下列有关数据增大的是( )
A、
| ||
| B、c(OH-) | ||
| C、Kw | ||
| D、pH |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:用水稀释氨水时,促进氨水电离,由NH3.H2O?OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,c(NH4+)减小,n(NH3.H2O)减少,所以c(NH3.H2O)减少,溶液的碱性减弱,Kw只受温度的影响,以此解答该题.
解答:
解:A.稀释氨水,n(NH3.H2O)减少,n(OH-)增大,则
增大,故A正确;
B.用水稀释氨水时,促进氨水电离,由NH3.H2O?OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,故B错误;
C.Kw只受温度的影响,加水稀释,Kw不变,故C错误;
D.c(OH-)减小,则pH减小,故D错误.
故选A.
| c(OH-) |
| c(NH3?H2O) |
B.用水稀释氨水时,促进氨水电离,由NH3.H2O?OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,故B错误;
C.Kw只受温度的影响,加水稀释,Kw不变,故C错误;
D.c(OH-)减小,则pH减小,故D错误.
故选A.
点评:本题考查弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,明确稀释时电离平衡的移动及离子的物质的量、离子的浓度的变化是解答的关键,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
常温下把Na、Mg、Al各0.1mol分别投入到100mL0.1mol/L的盐酸中,在相同条件下产生H2最多的是( )
| A、Na | B、Mg | C、Al | D、一样多 |
下列说法正确的是( )
| A、pH=0的溶液不存在 |
| B、中性溶液的pH不一定等于7 |
| C、使用广泛pH试纸测得某溶液的pH=3.5 |
| D、酸或碱溶液在稀释时,溶液的pH均减小 |
设NA为阿佛伽德罗常数,下列叙述正确的是( )
| A、28克氮气所含的氮原子数为2NA |
| B、1L1mol/L的盐酸中含有氯化氢分子为NA |
| C、标况下,11.2L水中所含的分子数为0.5NA |
| D、铁与盐酸中的反应,1mol铁失去的电子数为3NA |
下列说法不正确的是( )
A、实验证实环辛四烯( )可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 )可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 |
B、已知视网醛的结构为 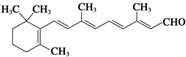 ,在它的同分异构体中属于萘( ,在它的同分异构体中属于萘( 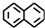 )的衍生物且能发生银镜反应的不止一种 )的衍生物且能发生银镜反应的不止一种 |
| C、三硝酸甘油酯的分子式为C3H5N3O9 |
| D、丙醇依次通过消去、加成、取代、去氢氧化、加氧氧化、还原反应可生成乳酸(2-羟基丙酸) |
“原子经济性”是“绿色化学”重要内涵.它主张在化学转化获取新物质的过程中充分利用每个原子,这样既能够充分利用资源,又能够防止污染.从“原子经济性”的角度考虑,以下转化最合理的是( )
| A、消除制硝酸工业尾气的氮氧化物污染:NO2+NO+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O | ||||
B、制备Cu(NO3)2:2Cu+O2
| ||||
C、利用二氧化碳制造全降解塑料 | ||||
D、用铜与浓硫酸共热制硫酸铜:Cu+2H2SO4(浓)
|
下列官能团的电子式正确的是( )
A、甲基 |
| B、羟基O:H |
C、醛基 |
D、羧基 |