题目内容
6. 氮及其化合物与科技、生活等密切相关.
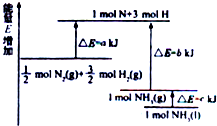
氮及其化合物与科技、生活等密切相关.(1)通过测定知,化学反应N2+3H2?2NH3的能量变化如图所示,请你写出生成气态氨的热化学方程式N2(g)+3H2(g)?NH3(g)△H=(a-b)kJ•mol-1.
(2)利用反应6NO2+8NH3$?_{△}^{催化剂}$7N2+12H2O也可以处理NO2,则该反应中发生氧化反应的物质是NH3;当转移2.4mol电子时,消耗NO2的体积在标准状况下是13.44L.
(3)2011年11月3日“天宫一号”与“神州八号”顺利实现太空交会对接,我国成为世界上第三个掌握此项技术的国家.运载火箭的燃料是一种叫联氨(N2H4)的物质(又称“肼”),在常温下是一种可燃性液体.
①传统制备肼的方法是以NaClO氧化NH3制得肼的稀溶液,该反应的离子方程式为ClO-+2NH3=N2H4+Cl-+H2O.
②已知:N2(g)+2O2(g)═2NO2(g)△H=67.7kJ•mol-1
N2 H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1
则反应2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)的△H=2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
③肼一空气燃料电池是一种以20~30% KOH为电解质溶液的碱性燃料电池,总反应方程式为N2H4+O2═N2+2H2O,该电池放电时负极反应式为N2H4+4OH--4e-=4H2O+N2.
分析 (1)根据图可知,生成1molNH3(g)放出的热量为b-akJ,由气体变为液体,放出热量为CkJ,放热反应的反应热△H为负值;
(2)物质发生氧化反应,化合价要升高;根据化合价的变化结合方程式计算;
(3)①NaClO氧化NH3生成肼和氯化钠;
②依据热化学方程式和盖斯定律计算得到热化学方程式;
③肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,正极上氧气得电子和水反应生成氢氧根离子,据此分析解答.
解答 解:(1)由图可知,生成1molNH3(g)放出的热量为b-akJ,则N2(g)+3H2(g)?NH3(g)△H=-(b-a)kJ/mol=(a-b)kJ•mol-1,
故答案为:N2(g)+3H2(g)?NH3(g)△H=(a-b)kJ•mol-1;
(2)在反应6NO2+8NH3$?_{△}^{催化剂}$7N2+12H2O中,NO2中N元素化合价降低,由+4价降低到0价,被还原,NH3中化合价升高被氧化,故被氧化的物质为NH3;在反应中则6molNO2参加反应,转移24mol电子,所以当转移2.4mol电子时,消耗NO20.6mol,体积为13.44L,故答案为:NH3;13.44;
(3)①制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液,反应为ClO-+2NH3=N2H4+Cl-+H2O,故答案为:ClO-+2NH3=N2H4+Cl-+H2O;
②由已知①N2(g)+2O2(g)═2NO2(g)△H=+67.7KJ/mol,②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534KJ/mol,
依据盖斯定律②×2-①得到肼与NO2完全反应的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
③肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:N2H4+4OH--4e-=4H2O+N2.
点评 本题考查了化学反应能量变化的计算应用和盖斯定律的计算,热化学方程式书写方法,题目难度中等.

| A. | HO(CH2)2CHO | B. | CH3CH(OH)COOH | C. | HOOC-COOH | D. | HO-CH2-CH2-OH |
| A. | 1﹕1 | B. | 1﹕m | C. | (n-4)﹕(6-n) | D. | (4-n)﹕(6-n) |
| A. | 酸碱中和滴定时,滴定管以及锥形瓶在使用前需用待装液润洗 | |
| B. | 测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,再对照标准比色卡读数 | |
| C. | 萃取时,振荡过程中放气是通过打开分液漏斗上口的玻璃塞进行的 | |
| D. | 做焰色反应时,可用光洁无锈的铁丝代替铂丝进行实验 |

 .
. +2nH2O
+2nH2O +2H2O.
+2H2O.

